Milioni di coppie in tutto il mondo sperimentano l’infertilità e metà dei casi hanno origine negli uomini. Per il 10% dei maschi infertili viene prodotto poco o nessun sperma. Ora, una nuova ricerca dello Stowers Institute for Medical Research, in collaborazione con il Wellcome Centre for Cell Biology dell’Università di Edimburgo, sta facendo luce su cosa potrebbe andare storto nel processo di formazione dello sperma, portando a potenziali teorie su possibili trattamenti.
I risultati dello studio sono stati pubblicati sulla rivista Science Advances.
Infertilità maschile: ecco cosa ha rivelato la nuova ricerca
“Una causa significativa di infertilità nei maschi è che non riescono a produrre lo sperma”, ha detto il ricercatore della Stowers Scott Hawley, Ph.D. “Se sai esattamente cosa c’è che non va, ci sono tecnologie emergenti proprio ora che potrebbero darti un modo per risolverlo.”
Lo studio pubblicato il 20 ottobre 2023 su Science Advances dell’Hawley Lab e del ricercatore del Wellcome Center Owen Davies, Ph.D., può aiutare a spiegare perché alcuni uomini non producono abbastanza sperma per fecondare un ovulo.
Nella maggior parte delle specie che si riproducono sessualmente, compreso l’uomo, è necessario costruire adeguatamente una struttura proteica critica simile a un ponte reticolare per produrre spermatozoi e ovuli. Il team guidato dall’ex ricercatrice associata post-dottorato Katherine Billmyre, Ph.D., ha scoperto che nei topi , la modifica di un singolo punto molto specifico in questo ponte ne causava il collasso, portando all’infertilità e fornendo così informazioni sull’infertilità umana nei maschi dovuta a problemi simili con la meiosi.
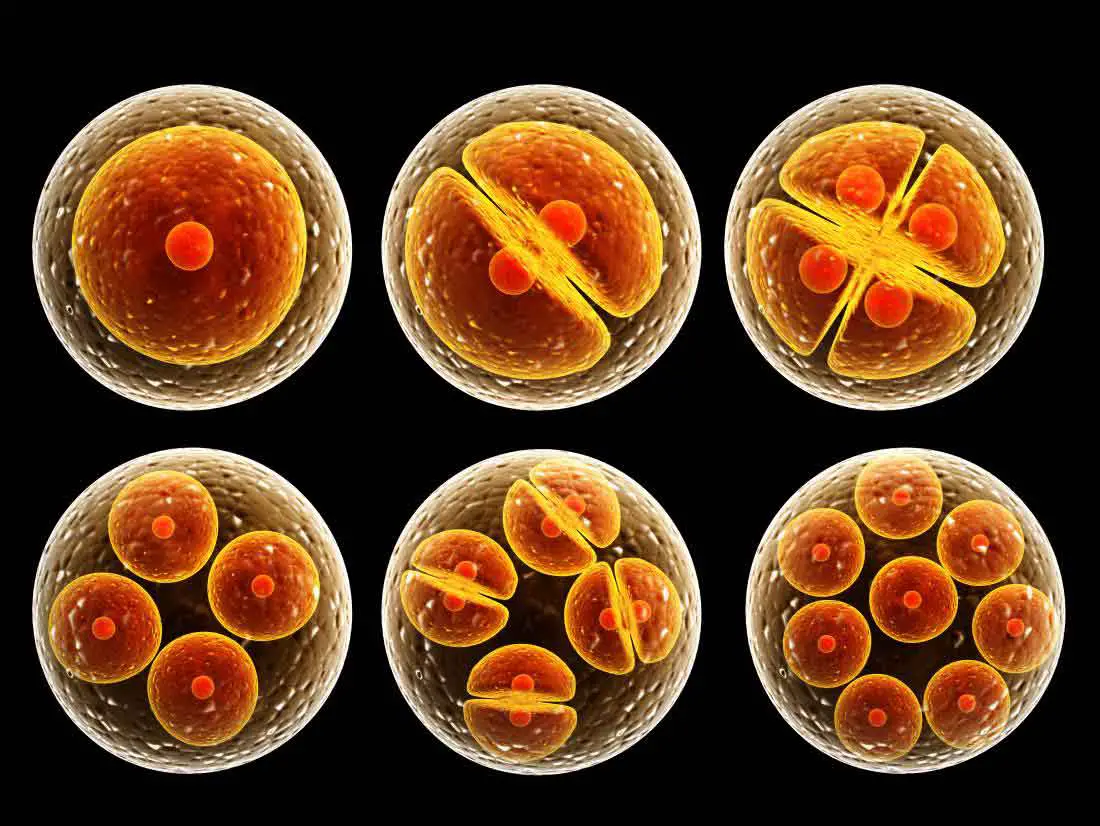
La meiosi, il processo di divisione cellulare che dà origine a sperma e ovuli, prevede diverse fasi, una delle quali è la formazione di una grande struttura proteica chiamata complesso sinaptonemico. Come un ponte, il complesso mantiene le coppie di cromosomi in posizione consentendo il verificarsi degli scambi genetici necessari affinché i cromosomi si separino correttamente in sperma e ovociti.
“Un contributo significativo all’infertilità sono i difetti della meiosi“, ha affermato Billmyre. “Per capire come i cromosomi si separano correttamente nelle cellule riproduttive, siamo davvero interessati a ciò che accade subito prima, quando tra di loro si forma il complesso sinaptonemico.”
Studi precedenti hanno esaminato molte proteine che compongono il complesso sinaptonemico, il modo in cui interagiscono tra loro e hanno identificato varie mutazioni legate all’infertilità maschile. La proteina studiata dai ricercatori in questo studio forma i reticoli del proverbiale ponte, che ha una sezione trovata negli esseri umani, nei topi e nella maggior parte degli altri vertebrati, suggerendo che sia fondamentale per l’assemblaggio.
La modellazione di diverse mutazioni in una regione potenzialmente cruciale nella proteina umana ha permesso al team di prevedere quale di queste potrebbe interrompere la funzione della proteina.
Gli autori hanno utilizzato una precisa tecnica di editing genetico per apportare mutazioni in una proteina chiave del complesso sinaptonemico nei topi, cosa che ha permesso ai ricercatori, per la prima volta, di testare la funzione delle regioni chiave della proteina negli animali vivi. Solo una singola mutazione, prevista dagli esperimenti di modellazione, è stata verificata come responsabile dell’infertilità nei topi.
“Stiamo parlando di un intervento chirurgico puntuale qui”, ha detto Hawley. “Ci siamo concentrati su una minuscola regione di una proteina in questa struttura gigantesca che eravamo abbastanza sicuri potesse essere una causa significativa di infertilità.”
I topi sono stati a lungo utilizzati come modelli per le malattie umane. Dagli esperimenti di modellizzazione che utilizzano sequenze di proteine umane, insieme all’elevata conservazione di questa struttura proteica tra le specie, la molecola precisa che ha causato l’infertilità nei topi probabilmente funziona allo stesso modo negli esseri umani.
“Ciò che è davvero entusiasmante per me è che la nostra ricerca può aiutarci a comprendere questo processo fondamentale necessario per la vita”, ha affermato Billmyre.
Per Hawley, questa ricerca è una vera rappresentazione della versatilità dell’Istituto. Il laboratorio di Hawley conduce tipicamente ricerche sui moscerini della frutta, ma la proteina scoperta in questo studio non era presente nei moscerini della frutta e richiedeva un diverso organismo di ricerca per continuare. Grazie alle risorse e ai centri tecnologici dell’Istituto, è stato possibile orientare e testare rapidamente la nuova ipotesi di infertilità nei topi.
Un gene che controlla il completamento della meiosi nella spermatogenesi è stato scoperto dai ricercatori dell’Università di Kumamoto. Finora non erano stati chiariti i dettagli del meccanismo che inattiva l’espressione dei geni coinvolti nel programma meiotico durante la spermatogenesi. I ricercatori ritengono che ciò potrebbe portare a un progresso nella medicina riproduttiva, come l’identificazione delle cause di infertilità dovute a azoospermia o difetti spermatogeni.
La meiosi è il tipo speciale di divisione cellulare che avviene nelle ovaie e nei testicoli per produrre ovociti e spermatozoi riducendo il numero di cromosomi alla metà dell’originale. Una volta completata la meiosi, il DNA continua ad essere altamente condensato e subisce importanti cambiamenti morfologici caratteristici della spermiogenesi.
Questo processo inattiva l’espressione di molti geni che precedentemente erano attivi nello svolgimento della meiosi nella spermiogenesi. Tuttavia, i dettagli del meccanismo che completa il programma meiotico al momento opportuno sono sconosciuti e, sebbene si tratti di un problema importante e direttamente correlato alla medicina riproduttiva, come l’infertilità maschile, è rimasto un problema irrisolto per molti anni.
Il gruppo del professor Ishiguro presso l’Istituto di embriologia molecolare e genetica (IMEG) dell’Università di Kumamoto aveva precedentemente scoperto la MEIOSINA, un gene che attiva la meiosi e provoca l’attivazione simultanea di centinaia di geni coinvolti nella formazione di sperma e ovuli. Tra questi, molti geni hanno funzioni non ancora del tutto comprese. Nel loro lavoro per accertare queste funzioni, i ricercatori hanno selezionato il gene ZFP541 da analizzare in dettaglio.
Quando la funzione del gene ZFP541 nei topi è stata eliminata mediante l’editing del genoma, le cellule germinali maschili hanno iniziato la meiosi ma sono morte nel processo provocando infertilità poiché non sono stati prodotti spermatozoi. Un’analisi dettagliata dei testicoli di questi topi ha rivelato che il gene ZFP541 svolge un ruolo essenziale nella regolazione della meiosi ed è un gene importante coinvolto nella produzione di sperma.
Inoltre, ZFP541 è espresso nella profase meiotica tardiva e si lega alle regioni regolatrici (chiamate promotori) di molti geni correlati alla meiosi. È noto che gli istoni acetilati sono presenti nella regione regolatrice dei promotori come marcatore dell’attivazione prolungata dell’espressione genica. Attraverso l’analisi della spettrometria di massa, i ricercatori hanno scoperto che ZFP541 si lega a una proteina sconosciuta chiamata KCTD19 e a un enzima chiamato HDAC1 che, come dimostrato da studi precedenti, rimuove i gruppi acetile dagli istoni. Questi risultati mostrano che ZFP541 e HDAC1 insieme eliminano il gruppo acetile dell’istone, inattivano l’espressione dei geni correlati alla meiosi e completano la meiosi.
Questa ricerca fa seguito alla nostra scoperta della MEIOSINA pubblicata nel febbraio 2020 e rivela parte della funzione di un gene sotto il controllo della MEIOSINA la cui funzione è ancora sconosciuta”, ha affermato il dottor Yuki Takada, che ha guidato lo studio.
“Sebbene questi risultati siano stati verificati nei topi, è noto che ZFP541 esiste anche negli esseri umani. Ci sono molti casi di infertilità nell’uomo in cui la causa è sconosciuta, ma ci aspettiamo che questo risultato contribuisca a chiarire la patogenesi dell’infertilità, in particolare quelli legati alla displasia dello sperma.”
I ricercatori ritengono inoltre che questo lavoro possa essere applicato allo sviluppo della tecnologia per il trattamento dell’infertilità. Chiarendo le funzioni di altri geni nel processo di formazione di ovuli e spermatozoi, sperano di dare un contributo significativo alla medicina riproduttiva.
Gli scienziati dell’Università di Newcastle hanno compreso l’importanza di un gene nel regolare la produzione di spermatozoi.
perfettamente funzionanti.
Per la prima volta gli esperti hanno identificato il ruolo del gene RBMXL2, che è molto simile a un possibile gene dell’infertilità presente sul cromosoma Y presente solo negli uomini. Ciò ha fornito al team un modello da manipolare poiché il cromosoma Y stesso è molto difficile da analizzare.
Lo studio, pubblicato su eLife, fa luce sul motivo per cui alcuni uomini potrebbero essere sterili poiché è stato dimostrato che RBMXL2 è essenziale per produrre sperma.
Gli scienziati hanno scoperto che l’eliminazione del gene RBMXL2 dal cromosoma 11 ha bloccato la produzione di sperma e questo apre la strada a ulteriori interessanti ricerche in questo settore.
Il professor David Elliott, presso l’Istituto di medicina genetica dell’Università di Newcastle, ha condotto lo studio internazionale durato 10 anni, che ha coinvolto esperti provenienti dall’America, da Edimburgo e dall’Europa continentale.
Ha detto: “L’infertilità maschile è un argomento poco compreso e questo studio ci aiuta a capire perché alcuni uomini potrebbero diventare sterili.
“Ciò è importante poiché molte coppie soffrono di infertilità e ciò può causare stress psicologico e avere anche conseguenze economiche in alcuni paesi poiché può influire sull’assistenza in età avanzata”.
La produzione di sperma e ovuli, e poi eventualmente della generazione successiva, dipende da un tipo speciale di divisione cellulare nota come meiosi. La meiosi è un punto caldo per l’espressione genica e lo sviluppo degli spermatozoi, che comporta la copia di lunghi tratti di DNA nell’RNA.
Senza l’importante gene RBMXL2, altri geni non vengono espressi correttamente: continuano a produrre, ma questo processo non si replica accuratamente, portando a errori che alla fine bloccano la produzione di sperma. Comprendere come RBMXL2 consente la produzione di spermatozoi, fornisce agli esperti un indizio su come funzionano i geni dell’infertilità simili sul cromosoma Y.
La ricerca ha scoperto che il blocco si è verificato mentre le cellule si dividevano nei testicoli per produrre spermatozoi, durante il processo di meiosi. Questo blocco significava che nessuna delle cellule si sviluppava in spermatozoi in grado di nuotare e fecondare gli ovuli.
Una tecnica nota come sequenziamento dell’RNA è stata utilizzata per monitorare l’espressione di milioni di RNA nei topi adolescenti.
Il professor Elliott ha dichiarato: “Il gene RBMXL2 è stato scoperto per la prima volta quasi 20 anni fa, ma nessuno fino ad ora sapeva cosa fa o perché è importante. Il gene si trova in tutti i mammiferi e prevediamo che problemi simili riscontrati nei topi si verificheranno negli uomini infertili , ma dobbiamo testarlo nella ricerca futura.”
Lo studio è stato finanziato dal Biotechnology and Biological Sciences Research Council e dal Wellcome Trust.
Aileen Feeney, amministratore delegato dell’organizzazione benefica nazionale per la fertilità dei pazienti, Fertility Network, ha dichiarato: “L’infertilità maschile è molto più diffusa di quanto solitamente riconosciuto: il motivo più comune per cui una coppia cerca un trattamento per la fertilità, come la fecondazione in vitro, è dovuto a ragioni di fertilità maschile.
“L’infertilità colpisce duramente anche gli uomini: uno studio recente del Fertility Network che esamina l’impatto dell’infertilità sugli uomini ha rivelato che la difficoltà a diventare padre ha influenzato la salute mentale, l’autostima, le relazioni, la vita sessuale, la mascolinità, la carriera e le finanze degli uomini.
“C’è ancora molto da fare per indagare sulle cause dell’infertilità maschile, ecco perché Fertility Network accoglie con favore questa ricerca dell’Università di Newcastle che, sebbene nelle primissime fasi, offre speranza per una maggiore comprensione della fertilità maschile in futuro.”
In uno studio internazionale della BJU condotto su 1644 uomini infertili, una durata più lunga dell’infertilità è stata associata a una conta spermatica inferiore e ad altri parametri di sperma alterato. Inoltre, l’età avanzata e un indice di massa corporea più elevato erano associati a una durata più lunga dell’infertilità.
Circa il 15% delle coppie in età riproduttiva non riesce a ottenere la gravidanza desiderata entro un periodo di 12 mesi, nonostante i rapporti sessuali regolari e non protetti. L’infertilità prolungata è stata considerata uno stress psicosociale per la coppia infertile che può portare a uno scarso adattamento coniugale e a una diminuzione della qualità della vita, ma il ruolo potenziale della durata dell’infertilità in termini di salute riproduttiva della coppia rimane poco studiato .
“I nostri risultati suggeriscono che la durata dell’infertilità dovrebbe essere considerata un potenziale fattore di rischio per alterazioni dei parametri spermatici negli uomini infertili. Inoltre, le coppie infertili dovrebbero essere informate delle associazioni trovate in questo studio”, ha affermato l’autore principale Dr. Luca Boeri, dell’IRCCS. Ospedale San Raffaele e Università Vita-Salute San Raffaele, in Italia.
Secondo il più ampio studio condotto finora che valuta la qualità dello sperma, la funzione riproduttiva e il rischio metabolico negli uomini sottoposti a valutazione della fertilità, il conteggio dello sperma di un uomo è un indicatore della sua salute generale. I risultati dello studio, condotto su 5.177 partner maschi di coppie infertili provenienti dall’Italia, saranno presentati domenica all’ENDO 2018, il 100° incontro annuale della Endocrine Society che si terrà a Chicago, Illinois.
“Il nostro studio mostra chiaramente che un basso numero di spermatozoi di per sé è associato ad alterazioni metaboliche, rischio cardiovascolare e bassa massa ossea”, ha affermato il ricercatore principale dello studio, Alberto Ferlin, MD, Ph.D. Recentemente si è trasferito come professore associato di endocrinologia presso l’Università di Brescia dall’Università di Padova, dove lo studio si è svolto in collaborazione con il professor Carlo Foresta, MD
“Gli uomini infertili possono avere importanti problemi di salute coesistenti o fattori di rischio che possono compromettere la qualità della vita e abbreviare la loro vita”, ha detto Ferlin, che è anche presidente della Società Italiana di Andrologia e Medicina Sessuale. “La valutazione della fertilità offre agli uomini un’opportunità unica per la valutazione della salute e la prevenzione delle malattie.”
Nello specifico, Ferlin e i suoi colleghi hanno scoperto che circa la metà degli uomini aveva un basso numero di spermatozoi e aveva una probabilità 1,2 volte maggiore rispetto a quelli con un numero di spermatozoi normale di avere un grasso corporeo maggiore (vita più grande e indice di massa corporea più alto, o BMI); pressione sanguigna più alta (sistolica o lettura massima), colesterolo “cattivo” (LDL) e trigliceridi; e abbassare il colesterolo “buono” (HDL).
Avevano anche una maggiore frequenza di sindrome metabolica, un insieme di questi e altri fattori di rischio metabolico che aumentano la possibilità di sviluppare diabete, malattie cardiache e ictus, hanno riferito i ricercatori. Anche una misura della resistenza all’insulina, un altro problema che può portare al diabete, era più alta negli uomini con un basso numero di spermatozoi.
Un basso numero di spermatozoi è stato definito come inferiore a 39 milioni per eiaculato, un valore utilizzato anche negli Stati Uniti. Tutti gli uomini coinvolti nello studio sono stati sottoposti ad un’analisi dello sperma come parte di una valutazione sanitaria completa nella clinica della fertilità dell’università, che includeva la misurazione dei loro ormoni riproduttivi e parametri metabolici.
I ricercatori hanno scoperto un rischio 12 volte maggiore di ipogonadismo, o bassi livelli di testosterone, negli uomini con un basso numero di spermatozoi. La metà degli uomini con bassi livelli di testosterone presentava osteoporosi o ridotta massa ossea, un possibile precursore dell’osteoporosi, come rilevato da una scansione della densità ossea.
Questi risultati dello studio, secondo Ferlin, suggeriscono che un basso numero di spermatozoi di per sé è associato a misure peggiori di salute cardiometabolica, ma che l’ipogonadismo è principalmente coinvolto in questa associazione. Ha avvertito che il loro studio non dimostra che un basso numero di spermatozoi causi disturbi metabolici, ma piuttosto che la qualità dello sperma è uno specchio della salute generale maschile.
La conclusione, ha sottolineato Ferlin, è che il trattamento dell’infertilità maschile non dovrebbe concentrarsi solo sull’avere un figlio quando i test diagnostici rilevano altri rischi per la salute, come sovrappeso, colesterolo alto o pressione alta.
“Gli uomini di coppie che hanno difficoltà a ottenere una gravidanza dovrebbero essere correttamente diagnosticati e seguiti dai loro specialisti della fertilità e dal medico di base perché potrebbero avere una maggiore possibilità di morbilità e mortalità“, ha affermato.
Secondo il lavoro presentato alla conferenza dell’Associazione Europea di Urologia a Monaco, gli uomini con problemi di fertilità corrono un rischio maggiore di malattie metaboliche con l’avanzare dell’età.
Circa il 15% delle coppie soffre di infertilità e in circa la metà dei casi ciò è dovuto all’infertilità maschile. È stato dimostrato che gli uomini con scarsa qualità dello sperma hanno una ridotta aspettativa di vita, ma le cause sono sconosciute e non sono stati sviluppati marcatori biochimici o strategie di prevenzione.
Un gruppo di ricercatori svedesi ha misurato i livelli degli ormoni sessuali e altri parametri biochimici negli uomini infertili e ha dimostrato che molti di loro sono a rischio di ipogonadismo (bassi livelli di ormoni sessuali), nonché di segni di malattie metaboliche e di osteoporosi .
Il gruppo ha preso 192 uomini con un basso numero di spermatozoi, che frequentavano il Centro di medicina riproduttiva dell’ospedale universitario di Skåne, a Malmö, e li ha confrontati con 199 controlli di pari età.
I ricercatori hanno confrontato i livelli di ormoni sessuali tra i gruppi, così come altri marcatori come la densità minerale ossea (che indica il rischio di osteoporosi) e l’HbA1c (un biomarcatore per il diabete).
I ricercatori hanno scoperto che un terzo degli uomini sotto i 50 anni con problemi di fertilità presentava segni biochimici di bassi livelli di ormoni sessuali (ad esempio bassi livelli di testosterone), noto come ipogonadismo. Questo era 7 volte più comune rispetto ai controlli.
Questi uomini avevano anche una bassa densità ossea – soprattutto negli uomini con bassi livelli di testosterone – che li esponeva ad un aumentato rischio di fratture e osteoporosi. Gli uomini ipogonadici hanno mostrato anche segni biochimici di glucosio elevato (con HbA1c elevato) e maggiori segni di resistenza all’insulina, indicando una tendenza al diabete.
Secondo il leader dello studio, il dottor Aleksander Giwercman (Ospedale universitario di Skåne e Università di Lund, Malmö, Svezia):
“Abbiamo scoperto che una percentuale significativa di uomini provenienti da coppie infertili mostra segni biochimici di ipogonadismo. Ciò potrebbe influire sulla loro fertilità, ma può anche fungere da segnale di allarme precoce per malattie metaboliche in età avanzata, come l’osteoporosi o il diabete .
Raccomanderemmo che i livelli degli ormoni riproduttivi dovrebbero essere controllati in tutti gli uomini che cercano consigli per problemi di fertilità. Quelli a rischio di malattie gravi dovrebbero essere seguiti dopo il completamento del trattamento per la fertilità. ”
Lo ha detto il professor Jens Sønksen (Copenaghen) dell’Ufficio dei congressi scientifici dell’Associazione europea di urologia.
“Questo studio è molto interessante, così come lo è la domanda che pone: se l’infertilità negli uomini di età inferiore ai 50 anni possa essere utilizzata come predittore dello sviluppo di malattie metaboliche tra cui il diabete e l’osteoporosi più avanti nella vita. C’è un significativo bisogno di ulteriori informazioni studi in questo campo”.