Il vaiolo delle scimmie si adatta contagiandoci, siamo diventati dei bersagli in movimento. Alcuni anni fa, i ricercatori hanno perlustrato i resti di 1867 persone vissute tra 30.000 e 150 anni fa alla ricerca di tracce genetiche di variola, il virus che causa il vaiolo.
Nei denti e nelle ossa di quattro nordeuropei dell’era vichinga, hanno trovato abbastanza DNA per ricostruire interi genomi variola. I virus sequenziati non erano diretti antenati del temuto ceppo variola che fu sradicato nella seconda metà del 20° secolo. Ma potrebbero avere un indizio su come il vaiolo sia diventato così mortale.
Nell’arco di 350 anni, il virus Viking ha perso diversi geni, hanno riferito i ricercatori in un articolo del 2020 su Science. I ricercatori avevano già visto questo modello. Anche il moderno virus del vaiolo ha perso diversi geni nel recente passato, sebbene a causa di diverse mutazioni.
Vederlo due volte “suggerisce che la perdita dei geni non è stata un incidente”, afferma il poxvirologo Antonio Alcamí del Centro di Biologia Molecolare Severo Ochoa di Madrid. Alcamí pensa che le perdite potrebbero aver reso la variola più virulenta, con conseguente tasso di mortalità del 30%.
In passato, il vaiolo potrebbe essere stato una “malattia lieve diffusa”, ha scritto in un commento che accompagna il documento. Ora, alcuni scienziati si chiedono: potrebbe succedere di nuovo qualcosa del genere?
Da maggio, un cugino molto meno letale della variola, il virus del vaiolo delle scimmie, si è diffuso in tutto il mondo, offrendo al virus opportunità senza precedenti di cambiare e adattarsi alla popolazione umana. Si evolverà per diventare più contagioso o causare malattie più gravi?
Nessuno lo sa, ma la storia recente con SARS-CoV-2 offre una lezione che fa riflettere. Dopo essere emerso a Wuhan alla fine del 2019, quel virus ha prima generato una serie di varianti che potrebbero diffondersi molto più velocemente dei loro progenitori e poi si è evoluto ulteriormente per eludere l’immunità umana.
I suoi trucchi hanno sorpreso anche alcuni scienziati che hanno studiato a lungo l’evoluzione virale. SARS-CoV-2 ha dimostrato che “se un nuovo virus sta entrando in uno spazio in cui non c’è immunità, può verificarsi un rapido adattamento”, afferma Aris Katzourakis, virologo evoluzionista dell’Università di Oxford.
Il vaiolo delle scimmie potrebbe presentare all’umanità sorprese altrettanto spiacevoli. A luglio, i ricercatori di Berlino hanno pubblicato un preprint che analizza le sequenze del genoma del virus trovate nelle lesioni di 47 pazienti con vaiolo delle scimmie.
Oltre a molti piccoli cambiamenti, hanno trovato un virus in cui un intero gene era duplicato e altri quattro erano semplicemente scomparsi. L’ultimo paragrafo del documento sembrava quasi un avvertimento:
“La conseguenza dei cambiamenti nei geni del poxvirus i cui prodotti non sono più necessari in un nuovo ospite o in un contesto altrimenti alterato è imprevedibile”, hanno affermato gli autori.
“Il fenotipo del virus del vaiolo delle scimmie che conosciamo negli ultimi 64 anni potrebbe non assomigliare al vaiolo delle scimmie umano del prossimo futuro”.
Molti ricercatori dicono che non dovremmo preoccuparci ancora troppo. Geoffrey Smith, un poxvirologo dell’Università di Cambridge, dubita che il virus del vaiolo delle scimmie si trasformerà prontamente in una versione molto più virulenta.
È noto che i massicci genomi dei poxvirus si evolvono a un ritmo lento e non si adattano facilmente per eludere l’immunità, poiché SARS-CoV-2 lo fa magistralmente.
E SARS-CoV-2 è un patogeno respiratorio selvaggiamente contagioso che ha infettato centinaia di milioni di persone nel suo primo anno nella popolazione umana.
Il vaiolo delle scimmie si sta diffondendo principalmente tra gli uomini che hanno rapporti sessuali con uomini e finora sono stati segnalati solo circa 60.000 casi, quindi ha molte meno opportunità di evolversi.
Ciò potrebbe cambiare, tuttavia. Un “brutto scenario”, afferma Bernard Moss, un ricercatore veterano del poxvirus presso l’Istituto nazionale di allergie e malattie infettive degli Stati Uniti, è che il virus si evolve per replicarsi più velocemente negli esseri umani.
Ciò gli consentirebbe di infettare più persone, il che a sua volta accelererebbe la sua evoluzione, rendendolo potenzialmente ancora più abile a infettare le persone. Per ora, il virus del vaiolo delle scimmie non è molto bravo a infettare gli esseri umani.
È un generalista che sembra prosperare in una vasta gamma di specie animali, la maggior parte dei quali roditori, nell’Africa subsahariana. Di tanto in tanto il virus si è riversato nelle persone, che a volte ne hanno infettate altre.
Sebbene i focolai siano diventati più frequenti negli ultimi anni, in genere sono stati piccoli. Dopo ogni emergenza il virus è scomparso di nuovo dalla popolazione umana. Questa volta è diverso, poiché il vaiolo delle scimmie ha continuato a diffondersi da persona a persona in un’epidemia globale.
“Non abbiamo mai visto questo virus con una tale opportunità di adattarsi agli esseri umani prima”, afferma Terry Jones, biologo computazionale presso il Charité University Hospital di Berlino e uno degli autori del preprint di luglio.
Vaiolo delle scimmie: albero genealogico virale
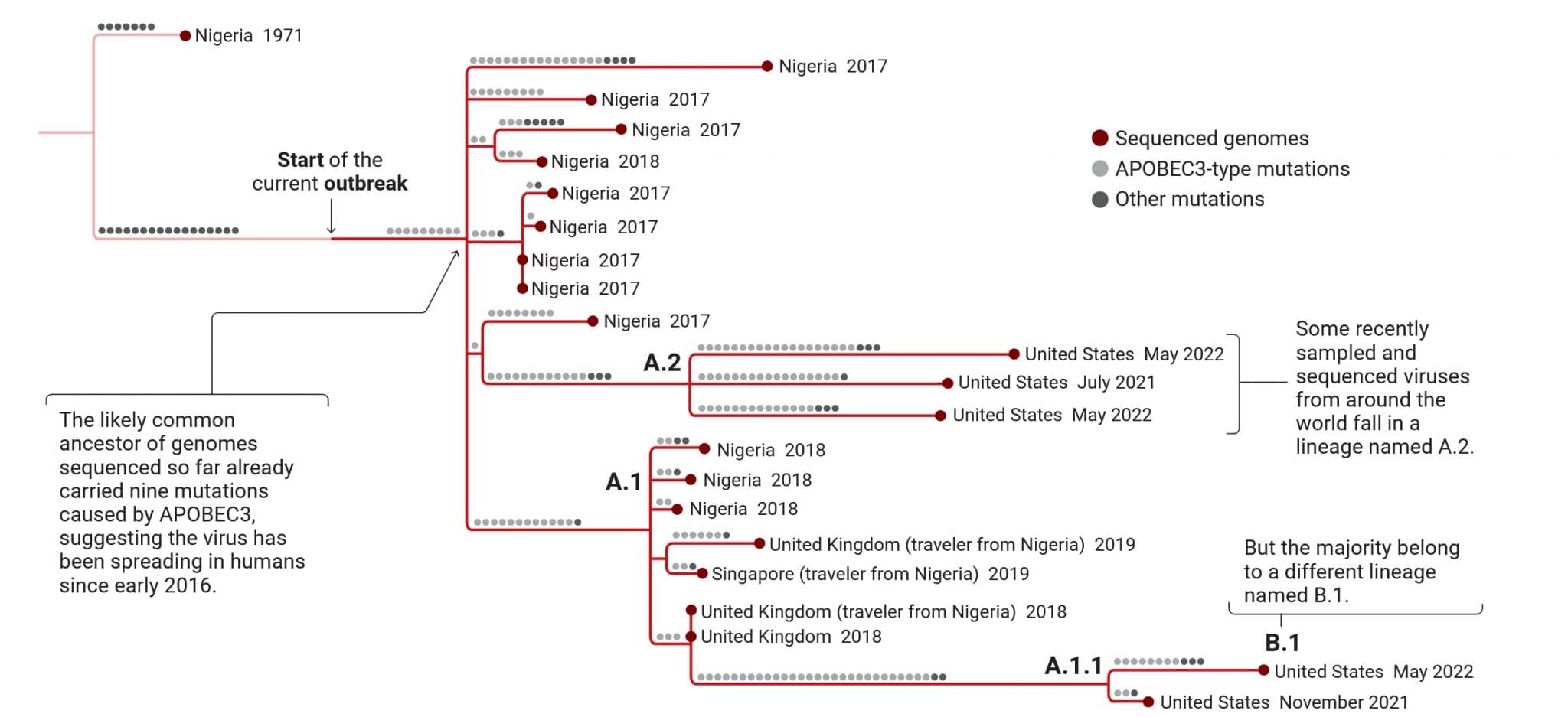
Le mutazioni osservate nei campioni di vaiolo delle scimmie consentono ai ricercatori di risalire alle radici dell’attuale epidemia, iniziata in Nigeria. Il virus è stato esportato più volte in altri paesi e alla fine si è diffuso in tutto il mondo. Perché probabilmente è stata introdotta una proteina umana, APOBEC3
molte delle mutazioni, possono anche mostrare da quanto tempo il virus si è diffuso nelle persone. I casi segnalati stanno diminuendo in molti paesi occidentali, molto probabilmente a causa di cambiamenti comportamentali e vaccinazioni, e i funzionari della sanità pubblica in Europa ne stanno già parlando eliminare il virus nella regione.
In Abruzzo è apparso un caso, ma non siamo ancora ai livelli americani. Ma le infezioni sono ancora in aumento in altre parti del mondo. In molti luoghi i vaccini non sono disponibili o le persone a rischio mancano di informazioni su come evitare l’infezione o temono di richiederle, perché il sesso tra gay è criminalizzato.
“Non credo che il vaiolo delle scimmie causerà un numero enorme di infezioni, ma rimarrà lì e sarà difficile sradicarlo”, afferma Alcamí. “I decisori devono rendersi conto che questo non andrà via presto”, aggiunge Christian Drosten, virologo di Charité e coautore del preprint di luglio.
La scienza non può fare altro che accennare a come il virus potrebbe evolversi mentre continua a circolare. Uno dei motivi è che l’interesse della ricerca sui poxvirus è diminuito dopo che la campagna mondiale di eradicazione del vaiolo si è conclusa trionfalmente nel 1980.
“Ho sempre dovuto iniziare i miei colloqui quasi scusandomi per aver lavorato sui poxvirus”, afferma Alcamí. I virologi evoluzionisti si sono invece concentrati sul virus dell’influenza, sull’HIV e su altri piccoli virus i cui genomi sono costituiti da RNA.
I poxvirus, al contrario, sono fatti di DNA e sono molto più grandi e complessi. Con circa 200.000 nucleotidi e 200 geni, il genoma del vaiolo delle scimmie è più di 20 volte più grande dell’HIV.
Non è chiaro cosa facciano molti di questi geni, dice Moss, per non parlare di come interagiscono tra loro o di come i cambiamenti in ognuno di essi potrebbero influenzare il loro impatto sugli esseri umani.
Moss ha cercato per anni di capire la differenza cruciale tra due varianti del virus del vaiolo delle scimmie: clade 2, che fino a poco tempo fa si trovava solo in Africa occidentale e ora sta causando l’epidemia globale, e clade 1, ritenuto molto più mortale, che ha causato focolai nella Repubblica Democratica del Congo per molti decenni.
Ha scoperto che il virus del clade 1 può uccidere un topo a livelli 1000 volte inferiori a quelli necessari con il clade 2. Per scoprire perché, Moss e i suoi colleghi hanno scambiato dozzine di geni del clade 2, uno alla volta, nel virus del clade 1, sperando di vederlo diventare meno mortale, ma finora senza fortuna.
Ora, stanno pianificando di provare l’opposto, dotando il virus clade 2 di geni del suo parente più letale. Una cosa è chiara, tuttavia: i poxvirus mutano lentamente rispetto ai virus a RNA. “I loro genomi sono piuttosto stabili e non cambiano rapidamente”, afferma Smith.
E sebbene i poxvirus abbiano modi per ingannare il sistema immunitario, non cambiano le loro proteine di superficie per sfuggire all’immunità, come fa il SARS-CoV-2.
Un’infezione da vaiolo, se sei sopravvissuto, ha fornito l’immunità per tutta la vita e i vaccini sono rimasti molto efficaci fino alla fine della campagna di eradicazione. Anche questo offre qualche speranza che il vaiolo delle scimmie non si trasformi in una minaccia più grande.
I ricercatori di tutto il mondo stanno ora estraendo i genomi del vaiolo delle scimmie da pazienti recenti per scoprire come si è evoluto il virus finora.
Ottenere sequenze di alta qualità è più difficile e più costoso di quanto non lo sia per SARS-CoV-2, non solo perché il genoma del vaiolo delle scimmie è così vasto, ma anche perché le regioni cruciali vicino alle sue estremità possono essere piene di ripetizioni o eliminazioni che possono far inciampare i ricercatori quando assemblano sequenze.
“La gestione di questi genomi è più complessa dei virus a RNA”, afferma Richard Neher, biologo computazionale dell’Università di Basilea. “Sarà più importante che con SARS-CoV-2 che le persone condividano i loro dati grezzi”.
Tuttavia, il lavoro sta già dando alcuni risultati. Quando i ricercatori hanno confrontato i genomi recenti dell’attuale epidemia di vaiolo delle scimmie con sequenze più vecchie, come quella isolata da un viaggiatore dalla Nigeria nel Regno Unito nel 2019, hanno subito notato due cose interessanti.
Una proteina umana potrebbe essere la causa delle mutazioni
I genomi presentavano più mutazioni puntiformi del previsto dopo solo pochi anni e molti di loro seguivano lo stesso schema, con la combinazione nucleotidica guanina-adenina che cambiava in adenina-adenina o timina-citosina che cambiava in timina-timina.
Quelle mutazioni sono probabilmente tracce di una lotta in corso tra il virus e il sistema immunitario umano. Una proteina umana chiamata APOBEC3 agisce come un meccanismo di difesa cellulare introducendo errori nel genoma virale mentre viene copiato e i cambiamenti individuati nei genomi del vaiolo delle scimmie ne sono la firma.
“Chiaramente, non è sufficiente fermare la replicazione del virus”, afferma il biologo evoluzionista molecolare Andrew Rambaut dell’Università di Edimburgo.
A lungo termine, tuttavia, le mutazioni potrebbero rendere il virus meno adatto man mano che si accumulano, oppure uno di loro potrebbe avvantaggiare il virus. Tuttavia, “La mia impressione è che questo probabilmente non sarà molto importante da un punto di vista evolutivo”, afferma Rambaut.
Ciò che queste mutazioni possono fare è fornire ai ricercatori un orologio per determinare da quanto tempo il vaiolo delle scimmie ha iniziato a circolare negli esseri umani.
Il confronto dei genomi di diversi punti temporali suggerisce che il virus sta attualmente aggiungendo circa sei cambiamenti correlati all’APOBEC3 all’anno, afferma Áine O’Toole, biologa evoluzionista di Edimburgo.
Un albero genealogico dei genomi dei virus dell’attuale focolaio suggerisce che i virus circolanti in Nigeria alla fine del 2017 portassero già nove mutazioni di tipo APOBEC3, il che significherebbe che il virus è entrato negli esseri umani all’inizio del 2016, circa un anno e mezzo prima che l’epidemia fosse riconosciuta in Nigeria.
L’analisi suggerisce anche che il virus sia circolato continuamente negli esseri umani da allora. Ma i poxvirus possono evolversi in altri modi più drastici rispetto ai cambiamenti dei singoli nucleotidi.
“Fanno un sacco di fuoristrada evolutivo”, afferma Nels Elde, virologo dell’Università dello Utah che si è rivolto al vaiolo delle scimmie dopo molti anni di studio del “vaccinia”, il poxvirus indebolito che fungeva da vaccino contro il vaiolo.
Elde spiega che i genomi del poxvirus di solito consistono in una regione centrale con circa 100 geni che sono per lo più coinvolti nella creazione di nuove copie del virus e regioni terminali con altri 100 circa geni che interagiscono con l’ospite, ad esempio per contrastare le difese immunitarie.
Quei geni terminali sembrano essere un sito chiave dell’evoluzione. I poxvirus generalisti che infettano molti ospiti diversi, inclusi il vaiolo delle scimmie e il vaiolo bovino, tendono ad avere più geni nelle regioni terminali, mentre il vaiolo, specializzato nell’infezione dell’uomo, ne ha molti di meno.
La maggior parte dei ricercatori ritiene che il vaiolo si sia evoluto da un virus del vaiolo dei roditori che è passato agli esseri umani. Nel tempo, le perdite genetiche come quelle osservate nel virus Viking potrebbero averlo reso più mortale, afferma il genetista evoluzionista molecolare Hendrik Poinar della McMaster University.
“Il vaiolo va da quella che pensiamo sia in realtà una forma molto avirulenta, all’inattivazione ripetuta del gene e continuerà in modo mostruoso finché non lo elimineremo”, dice Poinar.
Sulla base del documento Science del 2020 e del suo lavoro su un genoma variola di una mummia di un bambino del 17° secolo, Poinar crede che ciò sia accaduto tra il quarto e il 15° secolo.
Tuttavia, non è esattamente chiaro come la perdita di geni avrebbe reso la variola più virulenta. Il semplice fatto di avere un genoma più piccolo potrebbe rendere il virus più abile a replicarsi nelle cellule umane, afferma Eugene Koonin, ricercatore presso il National Center for Biotechnology Information degli Stati Uniti.
“Se cominciasse la replicazione, diciamo il 10% più velocemente, ecco sarebbe davvero un grosso problema”, afferma Koonin. “Una volta che succederà, questa variante supererà i concorrenti molto, molto rapidamente.”
I geni terminali possono anche evolversi attraverso un altro meccanismo. Spesso vengono duplicati durante la replicazione virale, il che può aiutare il virus in due modi.
Le copie aggiuntive gli consentono di produrre rapidamente molto più di una proteina necessaria e aumentano la possibilità che almeno una copia del gene subisca una mutazione benefica.
Il “miglioramento” può rendere ridondanti le altre copie e possono andare perse, accorciando il genoma. Elde, che ha studiato il meccanismo del virus vaccinia, lo chiama “fisarmonica genomica”.
Tali cambiamenti potrebbero influenzare il modo in cui il virus interagisce con il sistema immunitario umano, indebolendo le sue difese, ad esempio.
Ma cercare di prevedere gli effetti di specifiche mutazioni è come “le previsioni meteorologiche di merda”, dice Elde: “Abbiamo alcuni schemi e alcune previsioni che possiamo fare, ma non possiamo davvero sostenerli saldamente perché c’è un sistema meteorologico che ha enormi variabili che girano dappertutto.”
Da quando hanno pubblicato la prestampa a luglio, il laboratorio di Drosten ha studiato il virus isolato da un paziente a Berlino che aveva cancellato e duplicato geni. I risultati non ancora pubblicati sono inquietanti: “Nella coltura cellulare mostra una chiara differenza, replicandosi molto più velocemente”, afferma Drosten.
“Non dovremmo interpretarlo con un eccessivo pessimismo ecco”, avverte, perché i risultati in laboratorio non si traducono necessariamente in un vantaggio per il virus nel mondo reale. “Ma trovo straordinario che questo virus mostri già una differenza nella coltura cellulare”.
Se il virus ha avuto un vantaggio nel mondo reale ma semplicemente non si è trasmesso, allora l’umanità potrebbe essere stata “semplicemente fortunata”, dice Jones, “questa volta”.
Vede l’attuale focolaio come una corsa tra il virus del vaiolo delle scimmie e l’umanità: “Il virus sta cercando di adattarsi agli esseri umani e gli esseri umani stanno cercando di sbarazzarsi del virus”, afferma. “Chi avrà il sopravvento? A lungo termine, punterei i miei soldi sul virus”.
Qualunque cosa accada, l’epidemia offre ai ricercatori un’inaspettata possibilità di osservare l’evoluzione di un poxvirus in tempo reale. “Stiamo tutti prendendo gli indizi, mettendoli insieme e sperando che anche questa sia un’opportunità per far avanzare la scienza”, afferma Elde.
“Ma faccio il tifo per noi, faccio il tifo per gli umani. … Voglio imparare come funzionano questi virus e quindi utilizzare queste informazioni in modo da poter avere un certo controllo su questa situazione. “