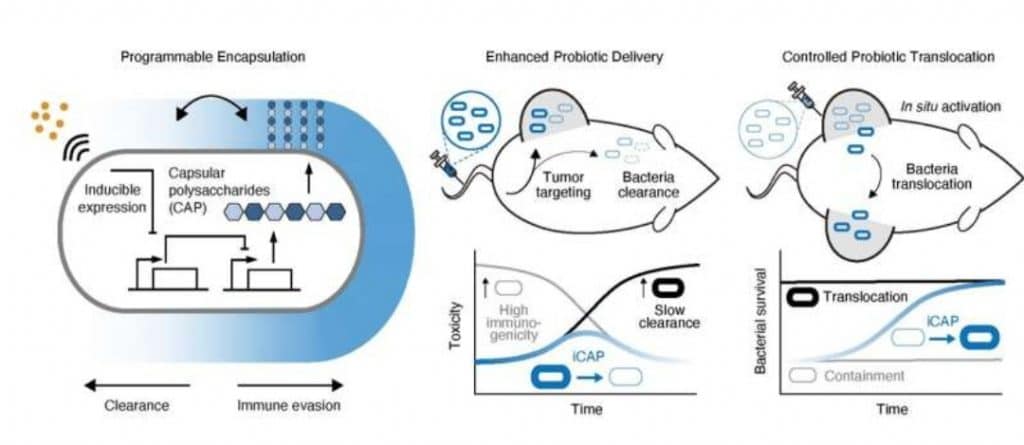
I ricercatori della Columbia Engineering hanno dichiarato di aver sviluppato un mantello invisibile per batteri: si tratta di un sistema di occultamento (iCAP) che nasconde temporaneamente i batteri terapeutici dal sistema immunitario, consentendo loro di somministrare in modo più efficace farmaci ai tumori e uccidere le cellule tumorali nei topi. Manipolando il DNA dei microbi, gli sviluppatori hanno programmato circuiti genici che controllano la superficie dei batteri, costruendo un mantello molecolare che incapsula i batteri stessi.

I risultati dell’esperimento sono stati pubblicati sulla rivista scientifica Nature Biotechnology.
iCAP, mantello invisibile per batteri: ecco di cosa si tratta
“La cosa davvero stimolante di questo lavoro è che siamo in grado di controllare dinamicamente il sistema”, ha affermato Tal Danino, professore associato di ingegneria biomedica, che ha co-diretto lo studio in collaborazione con Kam Leong, Samuel H. Sheng, Professore di ingegneria biomedica.
“Possiamo regolare il tempo in cui i batteri sopravvivono nel sangue umano e aumentare la dose massima tollerabile di batteri. Abbiamo anche mostrato che il nostro sistema apre una nuova strategia di rilascio dei batteri in cui possiamo iniettare batteri in un tumore accessibile e farli migrare in modo controllabile a tumori distali come metastasi, cellule tumorali che si diffondono ad altre parti del corpo“.
I ricercatori si sono basati sui polisaccaridi capsulari (CAP), polimeri di zucchero che ricoprono le superfici batteriche. In natura, la CAP aiuta molti batteri a proteggersi dagli attacchi, compreso il sistema immunitario: “Abbiamo dirottato il sistema CAP di un ceppo probiotico di E. coli Nissle 1917″, ha affermato Tetsuhiro Harimoto, Ph.D. studente nel laboratorio di Danino, co-autore principale dello studio.
“Con la CAP, questi batteri possono eludere temporaneamente l’attacco immunitario. Senza la CAP, perdono la protezione dell’incapsulamento e possono essere eliminati nel corpo. Quindi abbiamo deciso di provare a costruire un interruttore on/off efficace“, ha continuato Harimoto.
Per concretizzare il progetto, i ricercatori hanno dato vita ad un nuovo sistema CAP, che hanno chiamato CAP inducibile, o iCAP. Controllano il sistema iCAP dandogli un segnale esterno, una piccola molecola chiamata IPTG, che consente un’alterazione programmabile e dinamica della superficie cellulare di E. coli . Poiché iCAP altera le interazioni batteriche con i sistemi immunitari (come la clearance del sangue e la fagocitosi) in modo diretto, il team ha scoperto che potrebbero controllare il tempo in cui i batteri possono sopravvivere nel sangue umano, regolando la quantità di IPTG che danno a iCAP E .coli .
Sebbene l’uso dei batteri per la terapia sia un nuovo approccio alternativo al trattamento di un’ampia gamma di tumori, esistono una serie di problematiche da risolvere, una su tutte la loro tossicità. A differenza di molti farmaci tradizionali, questi batteri sono vivi e possono proliferare all’interno del corpo.
Sono anche rilevati dal sistema immunitario del corpo come estranei e pericolosi, causando un’elevata risposta infiammatoria – troppi batteri significano un’elevata tossicità dovuta a un’infiammazione eccessiva – o una rapida eliminazione dei batteri – troppo pochi batteri significano nessuna efficacia terapeutica.
Jaeseung Hahn, un ricercatore post-dottorato nei laboratori di Danino e Leong che ha co-diretto il progetto, ha osservato: “Negli studi clinici, è stato dimostrato che queste tossicità sono il problema critico, limitando la quantità che possiamo dosare i batteri e compromettendo l’efficacia. Alcuni studi ha dovuto essere interrotto a causa della grave tossicità“.
I batteri ideali dovrebbero essere capaci di eludere il sistema immunitario all’ingresso nel corpo e raggiungere in modo efficiente il tumore. E una volta che sono nel tumore, devono essere eliminati in altre parti del corpo per ridurre al minimo la tossicità. I ricercatori hanno sfruttato modelli di tumore del topo per dimostrare che, attraverso iCAP, potrebbero aumentare la dose massima tollerabile di batteri di 10 volte. Hanno incapsulato il ceppo di E. coli per consentirgli di eludere il sistema immunitario e raggiungere il tumore. Poiché non fornivano IPTG nel corpo, l’ iCAP di E. coli ha perso il suo incapsulamento nel tempo ed era più facile da eliminare in altre parti del corpo, riducendo così al minimo la tossicità.
Per testare l’efficacia, gli sviluppatori della nuova nanotecnologia hanno progettato E. coli iCAP per produrre una tossina antitumorale e sono stati in grado di ridurre la crescita del tumore nei modelli murini con cancro del colon-retto e della mammella più che nel gruppo di controllo senza il sistema iCAP.
Gli scienziati hanno anche parlato di una migrazione batterica controllabile all’interno dell’organismo. Studi precedenti hanno dimostrato che bassi livelli di batteri fuoriescono dai tumori durante la crescita del tumore stesso. Per questo nuovo studio, i ricercatori della Columbia si sono serviti di iCAP, per dimostrare che è possibile controllare la fuoriuscita di batteri da un tumore, nonché la loro traslocazione in altri tumori.
Gli studiosi hanno iniettato E. coli iCAP in un tumore e successivamente hanno nutrito i topi con acqua contenente IPTG, con attivato iCAP all’interno di un tumore e hanno visto E. coli iCAP fuoriuscire e migrare verso tumori non iniettati.
Il tram di studio sta studiando attentamente una serie di aree di ricerca. Esistono più di 80 diversi tipi di CAP che esistono solo per E. coli e anche di più per altre specie di batteri che potrebbero essere ingegnerizzati utilizzando approcci simili. Inoltre, la CAP non è l’unica molecola che i batteri hanno sulla loro superficie e altre molecole di superficie potrebbero essere controllate in modo simile.Non solo, mentre in questo esempio iCAP è controllato da un IPTG fornito esternamente, altri sistemi di controllo come i biosensori potrebbero essere utilizzati per controllare autonomamente le proprietà superficiali dei batteri terapeutici .
Il team, affiliato anche all’Herbert Irving Comprehensive Cancer Center e al Data Science Institute della Columbia, osserva che la traduzione clinica è la prossima grande sfida che vorrebbe affrontare.
“Sebbene ci sia una buona dose di ricerca di laboratorio che mostra vari modi per ingegnerizzare i microbi, è molto difficile applicare queste potenti terapie a un animale o a un corpo umano complesso. Abbiamo mostrato prove di concetto nei modelli murini, ma dato che gli esseri umani sono 250 volte più sensibile alle endotossine batteriche rispetto ai topi, ci aspettiamo che i nostri risultati possano avere un effetto ancora maggiore sui pazienti umani che sui topi”, ha affermato Harimoto.
Leong ha concluso: “La terapia del cancro batterico presenta vantaggi unici rispetto alla terapia farmacologica convenzionale, come il targeting efficiente del tessuto tumorale e il rilascio programmabile del farmaco. La potenziale tossicità ne ha limitato il pieno potenziale. L’approccio di cloaking presentato in questo studio potrebbe affrontare questo problema critico”.
Le terapie contro i tumori sono ad oggi limitate a chirurgia, radioterapia e chemioterapia. Tutti e tre i metodi rischiano di danneggiare i tessuti normali o l’eradicazione incompleta del cancro.
La nanotecnologia offre i mezzi per indirizzare le chemioterapie direttamente e selettivamente alle cellule cancerose e alle neoplasie, guidare nella resezione chirurgica dei tumori e migliorare l’efficacia terapeutica delle modalità di trattamento basate sulle radiazioni e altri trattamenti da protocollo. Tutto ciò può comportare una diminuzione del rischio per il paziente e una maggiore probabilità di sopravvivenza.
Secondo il National Cancer Institute: ” La ricerca sulla terapia del cancro nanotecnologica si estende oltre la somministrazione di farmaci alla creazione di nuove terapie disponibili solo attraverso l’uso delle proprietà dei nanomateriali. Sebbene piccole rispetto alle cellule, le nanoparticelle sono abbastanza grandi da incapsulare molti composti di piccole molecole, che possono essere di più tipi. Allo stesso tempo, l’area superficiale relativamente ampia delle nanoparticelle può essere funzionalizzata con ligandi, comprese piccole molecole, filamenti di DNA o RNA, peptidi, aptameri o anticorpi”.
“Questi ligandi possono essere utilizzati per effetti terapeutici o per dirigere il destino delle nanoparticelle in vivo. Queste proprietà consentono la somministrazione combinata di farmaci, il trattamento multimodale e l’azione combinata terapeutica e diagnostica, nota come “teranostica”. Le proprietà fisiche delle nanoparticelle, come l’assorbimento di energia e la ri-irradiazione, possono essere utilizzate anche per distruggere il tessuto malato”.