Un consorzio di 53 scienziati provenienti da sei paesi del Nord America, Europa e Asia ha dimostrato, in una recente ricerca come le varianti genetiche patogene siano causa di scompenso cardiaco. Secondo il nuovo studio infatti, La cardiomiopatia non è una malattia uniforme. Piuttosto, i difetti genetici individuali portano allo scompenso cardiaco in modi diversi.

I risultati dello studio sono stati pubblicati sulla rivista scientifica Science.
Varianti genetiche patogene e scompenso cardiaco: ecco cosa ha rivelato la nuova ricerca
I meccanismi molecolari e cellulari che portano all’insufficienza cardiaca nelle persone con cardiomiopatia sono determinati dalle specifiche varianti genetiche patogene che porta ogni paziente, secondo una ricerca recentemente pubblicata basata sulla prima analisi unicellulare completa di cellule cardiache da cuori sani e malati.
Lo studio ha evidenziato che le composizioni dei tipi cellulari ei profili di attivazione genica cambiano in base alle varianti genetiche patogene. La squadra di scienziati ha dichiarato che i risultati possono essere sfruttati per sviluppare terapie mirate che tengano conto del difetto genetico sottostante di ciascun paziente responsabile della loro particolare forma di cardiomiopatia.
Per poter sviluppare la ricerca, sono stati esaminatemi attentamente geni attivati in circa 880.000 singole cellule da 61 cuori malati e 18 cuori sani di donatori come riferimento. Sì è trattato di uno studio complesso che ha richiesto un team interdisciplinare.
Gli organi sono stati acquistati dal Brigham and Woman’s Hospital di Boston, Stati Uniti, dall’Università di Alberta in Canada, dall’Heart and Diabetes Center North Rhine-Westphalia a Bad Oeynhausen, dalla Ruhr University di Bochum in Germania e dall’Imperial College di Londra, Regno Unito.
Gli autori senior che hanno guidato il progetto sono Christine Seidman, professoressa di medicina e genetica alla Harvard Medical School e cardiologa al Brigham and Women’s Hospital; Jonathan Seidman, professore di genetica alla Harvard Medical School; Norbert Hübner, professore di scienze cardiovascolari e metaboliche presso il Max-Delbrück-Center for Molecular Medicine presso la Helmholtz Association (MDC) e la Charité—Universitätsmedizin Berlin.
Nonché il Dr. Gavin Oudit, University of Alberta, Canada; Professor Hendrik Milting, Heart and Diabetes Center NRW, Bad Oeynhausen, Università della Ruhr Bochum, Germania; Dr. Matthias Heinig, Helmholtz Monaco, Germania; La Dott.ssa Michela Noseda del National Heart and Lung Institute dell’Imperial College London, UK e la Professoressa Sarah Teichmann, Wellcome Sanger Institute di Cambridge, UK.
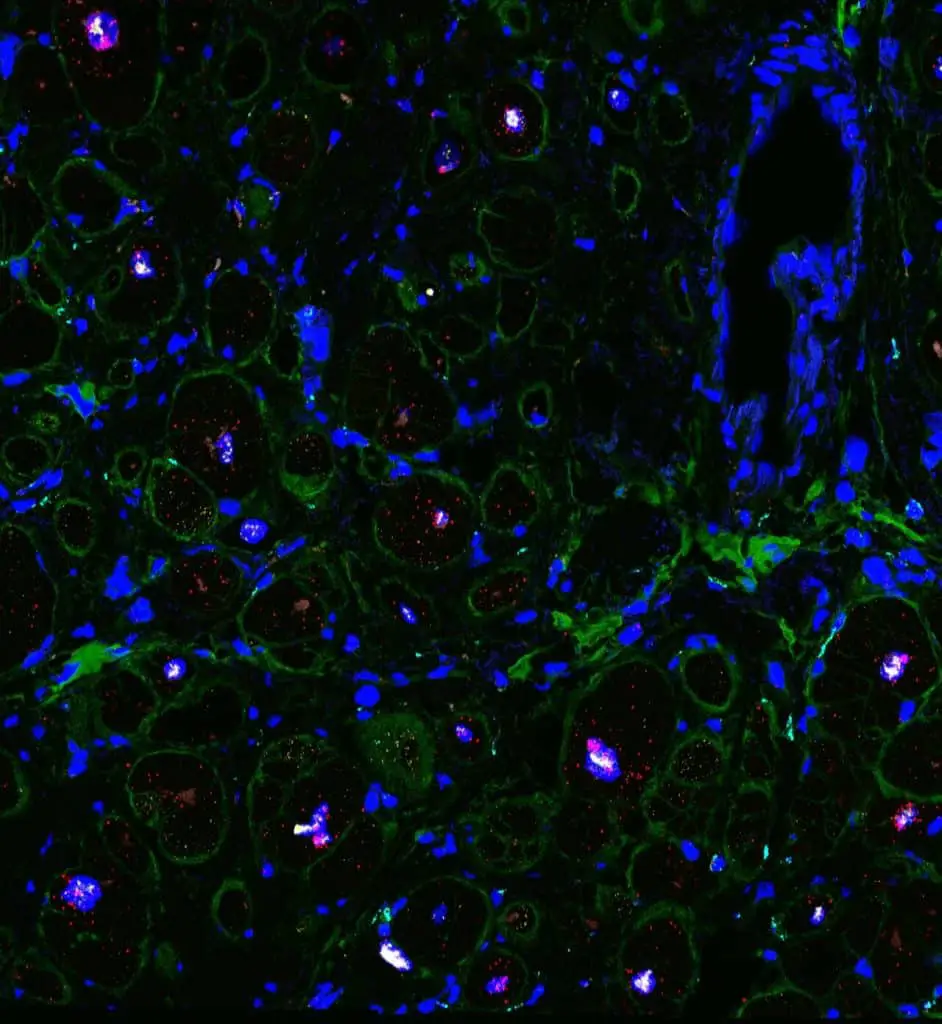
La squadra di scienziati si è concentrata sulla cardiomiopatia dilatativa (DCM), la forma più comune di insufficienza cardiaca che porta ai trapianti di cuore. Questa patologia cardiaca implica un’espansione (dilatazione) delle pareti della camera cardiaca, specialmente nel ventricolo sinistro, la principale camera di pompaggio del cuore.
I muscoli del cuore si indeboliscono, compromettendo la sua capacità di contrarsi e pompare il sangue, che alla fine porta all’insufficienza cardiaca.
l’equipe internazionale di studiosi ha esaminato attentamente i tessuti di pazienti con diverse varianti genetiche patogene che comunemente portano a cardiomiopatie. Queste mutazioni si sono verificate in proteine con diverse funzioni nel cuore e le analisi indicano che queste hanno innescato risposte diverse.
“Abbiamo studiato le varianti del gene patogeno nel tessuto cardiaco a livello unicellulare, il che ci ha permesso di mappare con precisione il modo in cui specifiche varianti genetiche patogene determinano la disfunzione cardiaca”, ha dichiarato il co-autore senior Norbert Hübner.
“Per quanto ne sappiamo, questa è la prima analisi di questo tipo condotta nel tessuto cardiaco e speriamo che questo approccio possa essere utilizzato per studiare altri tipi di malattie cardiache genetiche”.
Gli scienziati hanno caratterizzato con precisione le varie mutazioni in ciascuno dei cuori e le hanno confrontate tra loro, così come con cuori sani e con cuori in cui le cause della dilatazione e della disfunzione erano sconosciute. Ciascun tipo di cellula cardiaca e i numerosi sottotipi sono stati analizzati uno per uno, utilizzando metodi di sequenziamento unicellulari.
.
Nessun laboratorio da solo poteva gestire l’enorme quantità di dati generati, ma la stretta collaborazione tra specialisti di diverse discipline ha permesso di assemblare un’immagine coerente da ogni singolo pezzo del puzzle.
Questo studio fa anche parte del lavoro del consorzio internazionale Human Cell Atlas (HCA)., che mira a mappare ogni tipo di cellula nel corpo umano come base sia per la comprensione della salute umana che per la diagnosi, il monitoraggio e il trattamento delle malattie.
“Solo questo livello di risoluzione ci consente di vedere che le cardiomiopatie non attivano in modo uniforme gli stessi percorsi patologici”, ha affermato la co-autrice senior Christine Seidman: “Piuttosto, diverse mutazioni hanno evocato risposte specifiche e alcune condivise che portano allo scompenso cardiaco. Queste risposte specifiche del genotipo indicano opportunità terapeutiche che possono informare lo sviluppo di interventi mirati alla precisione”, ha continuato l’esperta.
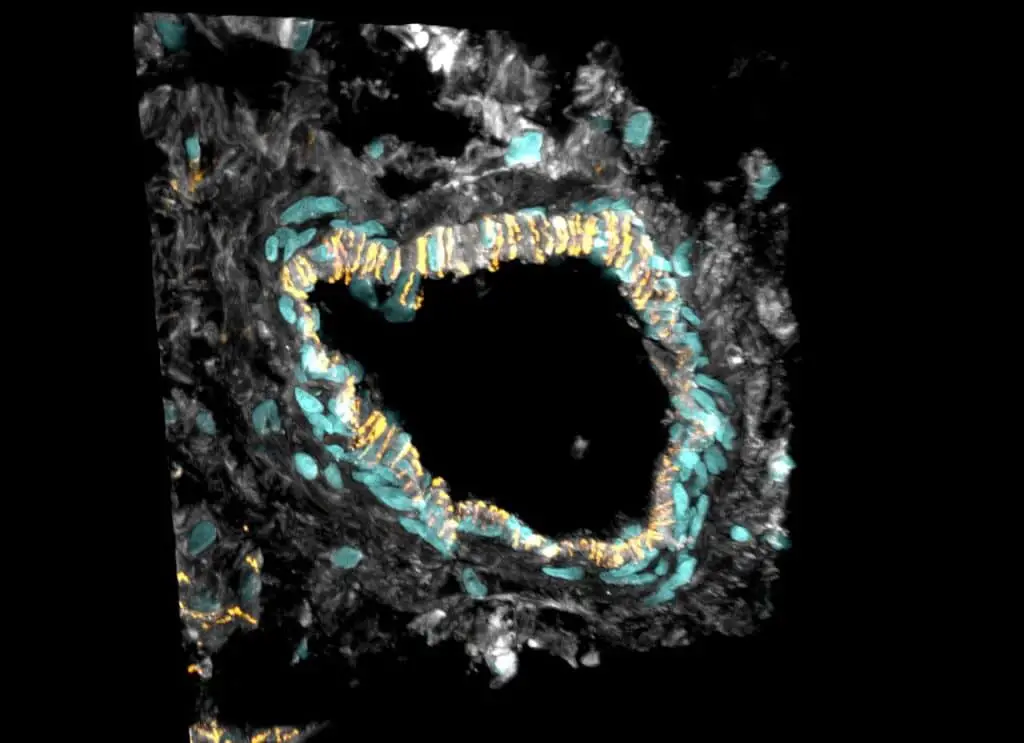
“Ad esempio, abbiamo scoperto che la fibrosi, la crescita anormale del tessuto connettivo, osservata nella DCM non è causata da un aumento del numero di fibroblasti nel cuore”, ha osservato Matthias Heinig, che ha condotto analisi computazionali.
“Il numero di queste cellule rimane lo stesso. Ma le cellule esistenti diventano più attive e producono più matrice extracellulare, che riempie lo spazio tra le cellule del tessuto connettivo”, ha aggiunto Eric Lindberg.
Pertanto, piuttosto che una sovrapproduzione di cellule fibrotiche, i ricercatori hanno osservato solo uno spostamento nella proporzione dei sottotipi cellulari, caratterizzato da un aumento del numero di fibroblasti specializzati nella produzione di matrice extracellulare.
“Il fenomeno è stato particolarmente pronunciato nel cuore dei pazienti con un gene RBM20 mutato”, ha spiegato Henrike Maatz. Questa osservazione è stata riscontrata anche nella storia medica dei pazienti.
In media, i pazienti con queste specifiche variazioni genetiche patogene hanno sofferto di insufficienza cardiaca e hanno avuto bisogno di un trapianto molto prima rispetto alle persone con altre forme genetiche di DCM. Il sequenziamento unicellulare ha rivelato un’intera serie di tali differenze specifiche del genotipo nei cuori dilatati.
Lo studio ha altresì rivelato che nel cuore delle persone con cardiomiopatie aritmogene (MAC), quelle che causano pericolosi disturbi del ritmo cardiaco, le cellule muscolari sono sempre più sostituite da cellule adipose e del tessuto connettivo, in particolare nel ventricolo destro.
Sebbene questa forma di cardiomiopatia possa anche essere causata da diverse variazioni genetiche patogene, la squadra internazionale di scienziati ha concentrato la sua analisi sul gene per la proteina placofilina-2, o PKP2 in breve.
Gli studiosi hanno confrontato le vie di segnalazione cellulare dalle cellule ottenute dai ventricoli destro e sinistro. I risultati identificano la causa dietro l’aumento della produzione di grasso cellulare nel muscolo cardiaco delle persone con questo tipo di cardiomiopatia.
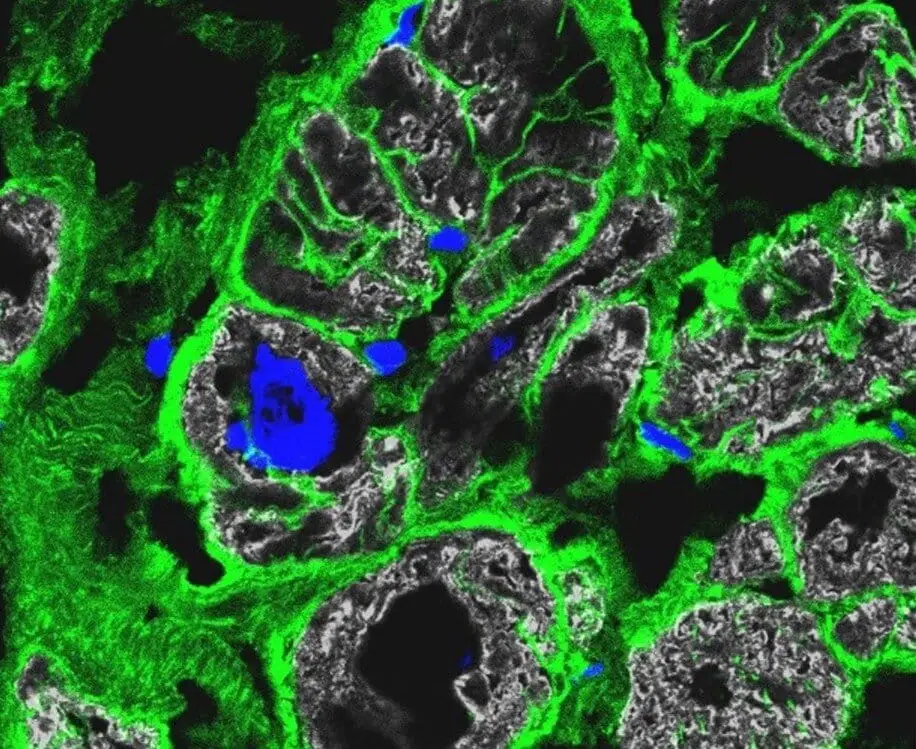
“Le firme molecolari precise ottenute per le cellule altamente specializzate del cuore ci hanno permesso di prevedere le vie di comunicazione cellula-cellula”, è intervenuta Michela Noseda.
l’équipe di esperti ha rivelato che diverse cause genetiche di cardiomiopatie erano associate a specifiche aberrazioni delle reti di comunicazione cellulare: “Questa è una chiara prova di meccanismi specifici che guidano la malattia”.
Infine, gli scienziati hanno usufruito dell’intelligenza artificiale per sviluppare un modello da tutti questi dati. Sulla base dei modelli specifici dei cambiamenti molecolari nei vari tipi cellulari, l’algoritmo può prevedere con un alto grado di sicurezza quali varianti genetiche patogene sono presenti, confermando che le differenze nell’attivazione genica e cellulare sono associate a varianti genetiche patogene di geni specifici.
“L’obiettivo finale è sviluppare terapie individualizzate per le malattie cardiache”, hanno affermato i ricercatori,?’ “Perché il trattamento specifico del genotipo potrebbe essere più efficace e con meno effetti collaterali”.
“Il consorzio ha messo a disposizione della comunità scientifica online tutti i suoi risultati. Seidman spera che questa risorsa spinga gli studi di altri gruppi a definire nuovi trattamenti che prevengano l’insufficienza cardiaca, che oggi è una malattia incurabile”.
“Abbiamo studiato i tessuti dei pazienti che avevano bisogno di un trapianto di cuore; era la loro ultima opzione”, ha osservato Hendrik Milting: “Ci auguriamo che i futuri trattamenti farmacologici almeno rallentino la progressione della malattia e che i dati del nostro studio contribuiranno a far sì che ciò accada”.

Nel frattempo, il team di ricerca ha identificato il suo prossimo lavoro: “Il tessuto cardiaco che abbiamo studiato proveniva da persone nella fase finale di una malattia”, ha concluso Daniel Reichart, uno dei primi autori.
“Siamo entusiasti di vedere quali cambiamenti scopriamo nelle prime fasi della malattia, ad esempio sulla base di biopsie endomiocardiche”. Forse si troveranno biomarcatori e percorsi che delucidano le varianti genetiche patogene della malattia molto precisa che consentirà davvero di praticare la medicina personalizzata, ha aggiunto Gavin Oudit.