I neuroscienziati del MIT hanno scoperto che il cervello adulto contiene milioni di “sinapsi silenziose”, connessioni immature tra neuroni che rimangono inattive fino a quando non vengono reclutate per aiutare a formare nuovi ricordi.
Fino ad ora, si credeva che le sinapsi silenziose fossero presenti solo durante lo sviluppo iniziale, quando aiutano il cervello ad apprendere le nuove informazioni a cui è esposto all’inizio della vita. Tuttavia, il nuovo studio del MIT ha rivelato che nei topi adulti circa il 30% di tutte le sinapsi nella corteccia cerebrale sono silenziose.
L’esistenza di queste sinapsi silenziose può aiutare a spiegare come il cervello adulto sia in grado di formare continuamente nuovi ricordi e apprendere nuove cose senza dover modificare le sinapsi convenzionali esistenti, affermano i ricercatori.
“Queste sinapsi silenziose sono alla ricerca di nuove connessioni e quando vengono presentate nuove informazioni importanti, le connessioni tra i neuroni rilevanti vengono rafforzate. Ciò consente al cervello di creare nuovi ricordi senza sovrascrivere i ricordi importanti immagazzinati nelle sinapsi mature, che sono più difficili da modificare”.
Afferma Dimitra Vardalaki, una studentessa laureata del MIT e autrice principale del nuovo studio.
Mark Harnett, professore associato di cervello e scienze cognitive, è l’autore senior dell’articolo, che appare oggi su Nature. Anche Kwanghun Chung, professore associato di ingegneria chimica al MIT, è un autore.
Una scoperta sorprendente
Quando gli scienziati hanno scoperto per la prima volta le sinapsi silenziose decenni fa, sono state osservate principalmente nel cervello di giovani topi e altri animali. Durante lo sviluppo iniziale, si ritiene che queste sinapsi aiutino il cervello ad acquisire l’enorme quantità di informazioni di cui i bambini hanno bisogno per conoscere il loro ambiente e come interagirci.
Nei topi, si credeva che queste sinapsi scomparissero intorno ai 12 giorni di età (equivalenti ai primi mesi di vita umana). Tuttavia, alcuni neuroscienziati hanno proposto che le sinapsi silenziose possano persistere nell’età adulta e aiutare con la formazione di nuovi ricordi. La prova di ciò è stata vista nei modelli animali di dipendenza, che si pensa sia in gran parte un disturbo dell’apprendimento aberrante.
Il lavoro teorico sul campo di Stefano Fusi e Larry Abbott della Columbia University ha anche proposto che i neuroni debbano mostrare un’ampia gamma di diversi meccanismi di plasticità per spiegare come i cervelli possano apprendere in modo efficiente nuove cose e conservarle nella memoria a lungo termine.
In questo scenario, alcune sinapsi devono essere stabilite o modificate facilmente, per formare i nuovi ricordi, mentre altre devono rimanere molto più stabili, per preservare i ricordi a lungo termine.
Nel nuovo studio, il team del MIT non si è proposto specificamente di cercare sinapsi silenziose. Invece, stavano dando seguito a una scoperta intrigante di uno studio precedente nel laboratorio di Harnett.
In quel documento, i ricercatori hanno dimostrato che all’interno di un singolo neurone, i dendriti, estensioni simili ad antenne che sporgono dai neuroni, possono elaborare l’input sinaptico in modi diversi, a seconda della loro posizione.
Come parte di quello studio, i ricercatori hanno cercato di misurare i recettori dei neurotrasmettitori in diversi rami dendritici, per vedere se ciò avrebbe aiutato a spiegare le differenze nel loro comportamento. Per fare ciò, hanno usato una tecnica chiamata eMAP (epitope-preserving Magnified Analysis of the Proteome), sviluppata da Chung.
Utilizzando questa tecnica, i ricercatori possono espandere fisicamente un campione di tessuto e quindi etichettare proteine specifiche nel campione, rendendo possibile ottenere immagini ad altissima risoluzione.
Mentre stavano facendo quell’imaging, hanno fatto una scoperta sorprendente. “La prima cosa che abbiamo visto, che era super bizzarro e che non ci aspettavamo, era che c’erano filopodi ovunque”, dice Harnett.
I filopodi, sottili sporgenze di membrana che si estendono dai dendriti, sono stati visti prima, ma i neuroscienziati non sapevano esattamente cosa facessero. Ciò è in parte dovuto al fatto che i filopodi sono così piccoli che sono difficili da vedere utilizzando le tradizionali tecniche di imaging.
Dopo aver fatto questa osservazione, il team del MIT ha cercato di trovare filopodi in altre parti del cervello adulto, utilizzando la tecnica eMAP. Con loro sorpresa, hanno trovato filopodia nella corteccia visiva del topo e in altre parti del cervello, a un livello 10 volte superiore a quello visto in precedenza.
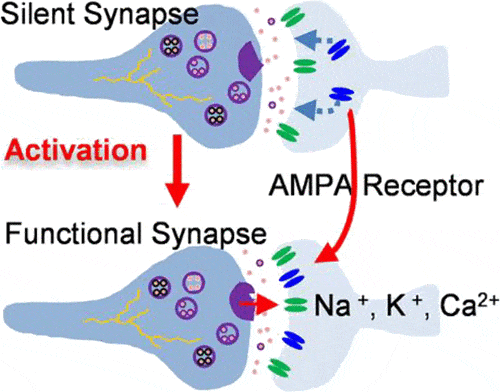
Hanno anche scoperto che la filopodia aveva recettori per neurotrasmettitori chiamati recettori NMDA, ma nessun recettore AMPA. Una tipica sinapsi attiva ha entrambi questi tipi di recettori, che legano il neurotrasmettitore glutammato.
I recettori NMDA normalmente richiedono la cooperazione con i recettori AMPA per trasmettere i segnali perché i recettori NMDA sono bloccati dagli ioni di magnesio al normale potenziale di riposo dei neuroni. Pertanto, quando i recettori AMPA non sono presenti, le sinapsi che hanno solo recettori NMDA non possono far passare una corrente elettrica e sono chiamate “silenziose”.
Sinapsi non silenzianti
Per indagare se questi filopodi potrebbero essere sinapsi silenziose, i ricercatori hanno usato un modificato
versione di una tecnica sperimentale nota come patch clamping. Ciò ha permesso loro di monitorare l’attività elettrica generata nei singoli filopodi mentre cercavano di stimolarli imitando il rilascio del neurotrasmettitore glutammato da un neurone vicino.
Usando questa tecnica, i ricercatori hanno scoperto che il glutammato non genererebbe alcun segnale elettrico nel filopodio che riceve l’input, a meno che i recettori NMDA non fossero sbloccati sperimentalmente. Ciò offre un forte supporto alla teoria che i filopodi rappresentano sinapsi silenziose all’interno del cervello, affermano i ricercatori.
I ricercatori hanno anche dimostrato di poter “silenziare” queste sinapsi combinando il rilascio di glutammato con una corrente elettrica proveniente dal corpo del neurone. Questa stimolazione combinata porta all’accumulo di recettori AMPA nella sinapsi silenziosa, permettendole di formare una forte connessione con l’assone vicino che sta rilasciando glutammato.
I ricercatori hanno scoperto che convertire le sinapsi silenziose in sinapsi attive era molto più facile che alterare le sinapsi mature.
“Se inizi con una sinapsi già funzionante, quel protocollo di plasticità non funziona”, dice Harnett. “Le sinapsi nel cervello adulto hanno una soglia molto più alta, presumibilmente perché vuoi che quei ricordi siano piuttosto resistenti. Non vuoi che vengano costantemente sovrascritti. La filopodia, d’altra parte, può essere catturata per formare nuovi ricordi”.
I risultati offrono supporto alla teoria proposta da Abbott e Fusi secondo cui il cervello adulto include sinapsi altamente plastiche che possono essere reclutate per formare nuovi ricordi, affermano i ricercatori.
“Questo documento è, per quanto ne so, la prima vera prova che questo è il modo in cui funziona effettivamente nel cervello di un mammifero”, afferma Harnett. “Filopodia consente a un sistema di memoria di essere sia flessibile che robusto. Hai bisogno di flessibilità per acquisire nuove informazioni, ma hai anche bisogno di stabilità per conservare le informazioni importanti.”
I ricercatori stanno ora cercando prove di queste sinapsi silenziose nel tessuto cerebrale umano. Sperano anche di studiare se il numero o la funzione di queste sinapsi è influenzato da fattori come l’invecchiamento o le malattie neurodegenerative.
“È del tutto possibile che modificando la quantità di flessibilità che hai in un sistema di memoria, potrebbe diventare molto più difficile cambiare i tuoi comportamenti e le tue abitudini o incorporare nuove informazioni”, afferma Harnett.
“Potresti anche immaginare di trovare alcuni degli attori molecolari coinvolti nella filopodia e provare a manipolare alcune di queste cose per cercare di ripristinare la memoria flessibile con l’avanzare dell’età”.
La ricerca è stata finanziata dal Boehringer Ingelheim Fonds, dal National Institutes of Health, dal James W. and Patricia T. Poitras Fund del MIT, da una Klingenstein-Simons Fellowship, da una borsa di studio della Vallee Foundation e da una borsa di studio McKnight.