Se in un certo momento storico la produzione di organoidi era relegata al campo della fantascienza futuristica, oggi è diventata una realtà bioscientifica che promuove lo sviluppo di organoidi per poter dare vita a nuove realtà sul fronte delle terapie performanti per diverse patologie. Esistono però ancora degli ostacoli come la produzione di questi importanti strumenti dell’apparato digerente, difficile da riprodurre.

Anche con intere squadre di scienziati altamente qualificate che sfruttano tutte le migliori combinazioni e attrezzature, un lotto di materiale di partenza può generare molti piccoli sferoidi di cellule precursori degli organi che possono quindi essere coltivate in tipi di organoidi specifici. Resta però la preoccupazione per il lotto successivo che potrebbe produrre pochi sferoidi o nessuno.
Di conseguenza, i team di laboratorio spesso subiscono ritardi nel produrre gli organoidi di cui hanno bisogno per esperimenti preclinici che cercano di testare la sicurezza o la potenza di potenziali farmaci o per la ricerca di base per approfondire le attività genetiche e molecolari che causano la malattia.
A dare speranza è una squadra di esperti del Cincinnati Children’s che ha dichiarato di possedere un metodo che ha superato gli ostacoli nella produzione. Il nuovo metodo viene già utilizzato per far avanzare gli studi all’interno del centro medico. Ma poiché i materiali coinvolti possono essere congelati e scongelati e continuano a produrre organoidi di alta qualità, questa scoperta consente di spedire materiali di partenza ad altri laboratori in qualsiasi parte del mondo, il che potrebbe innescarnee un uso notevolmente accelerato gastrointestinali durante la ricerca.
I risultati dello studio sono stati pubblicati sulla rivista scientifica Stem Cell Reports.
Produzione di organoidi per accelerare la ricerca: ecco in cosa consiste il nuovo metodo
“Questo metodo può rendere gli organoidi uno strumento più accessibile”, ha dichiarato la prima autrice Amy Pitstick, MS, manager della Pluripotent Stem Cell Facility di Cincinnati Children’s: “Mostriamo che l’approccio di aggregazione produce costantemente rese elevate e abbiamo dimostrato che le cellule precursori possono essere scongelate dallo stoccaggio cyrogenico per produrne dell’intestino tenue”.
“L’utilizzo di questo approccio consentirà a molti laboratori di ricerca di utilizzare organoidi nei loro esperimenti senza il tempo e le spese necessarie per imparare a coltivare cellule staminali pluripotenti indotte (iPSC)”, è intervenuto l’autore corrispondente Chris Mayhew, direttore di la struttura delle cellule staminali pluripotenti. “La capacità di congelare le cellule precursori consentirà inoltre ai laboratori di produrnre facilmente senza dover iniziare ogni nuovo esperimento con una differenziazione iPSC complicata e altamente variabile”.
In genere, per poter produrre di organoidi si rende necessaria la raccolta di cellule della pelle o del sangue che vengono convertite in laboratorio per produrre iPSC. Per utilizzarli per produrne di intestinali, il personale di laboratorio altamente qualificato ha coltivato uno strato piatto di cellule precursori degli organi chiamato endoderma dell’intestino medio.
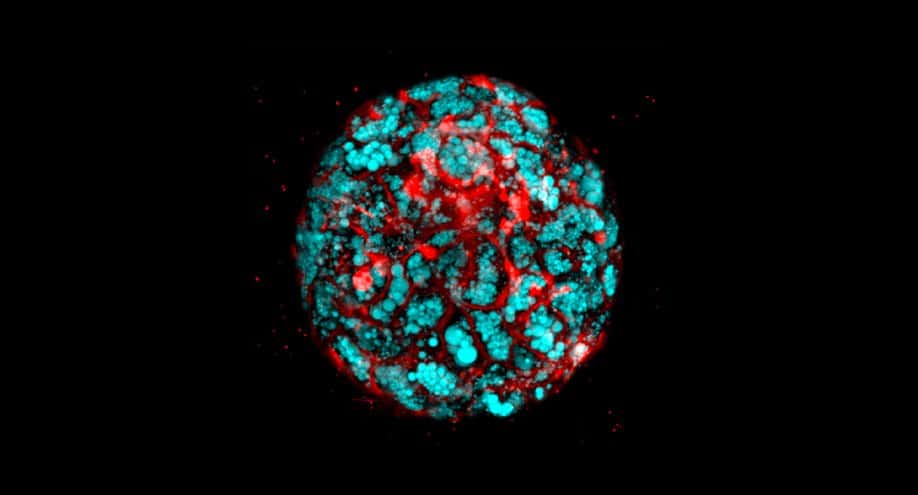
Date le giuste condizioni, gli organoidi allo stadio iniziale chiamati sferoidi si formano spontaneamente in sfere di cellule 3D. Questi vengono raccolti e trasferiti in un mezzo di crescita che fornisce i segnali necessari affinché le cellule si formino nei tipi cellulari specifici di un organo umano, in questo caso l’intestino tenue. Ma il numero di sferoidi generati in questo modo si è rivelato incoerente.
Il gruppo di esperti del Cincinnati Children’s ha stabilito che era possibile raccogliere lo strato di cellule precursori inutilizzato e utilizzare una centrifuga per guidare le cellule in centinaia di minuscoli pozzetti contenuti su piccole lastre di plastica. Questo ha richiesto la formazione di aggregati cellulari 3D che possono essere raccolti e utilizzati per la produzione di organoidi. I test dettagliati nel documento mostrano che gli sferoidi realizzati in questo modo non hanno differenze significative da quelli che sono cresciuti spontaneamente.
Un un secondo step, la squadra di scienziati altamente qualificata ha posizionato i campioni delle cellule precursori nei congelatori per la conservazione. Una volta che queste cellule sono state scongelate e aggregate, hanno anche formato sferoidi vitali.La ricerca ha confermato che questi sferoidi possono essere cresciuti in modo affidabile in organoidi più maturi che imitano le funzioni dell’intestino tenue, dell’intestino crasso (colon) e della parte inferiore dello stomaco che si collega all’intestino (antro).
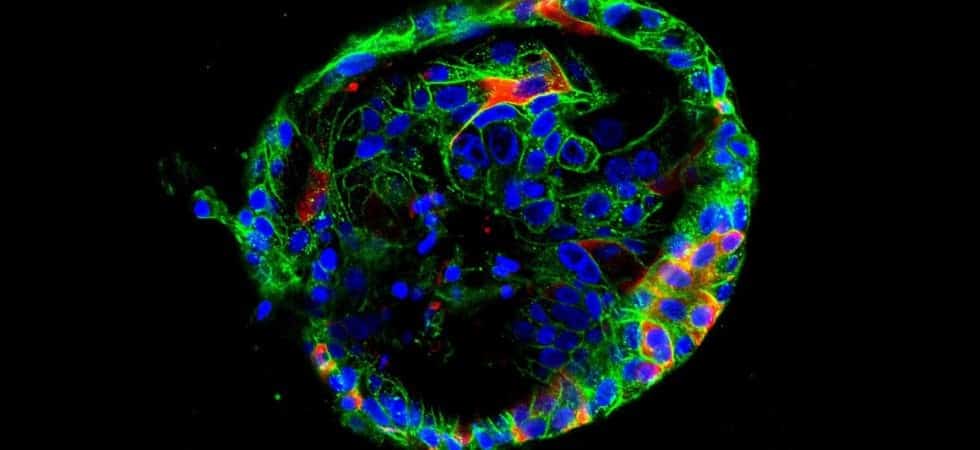
Nonostante questo importante progresso, saranno necessari anni di ricerche per sviluppare organoidi sufficientemente grandi e sufficientemente sofisticati da poter essere utilizzati come tessuto sostitutivo nella chirurgia dei trapianti. Ma averbe molti facili da produrre apre molte porte alla ricerca medica.
Altri laboratori saranno in grado di creare organoidi specifici per il paziente per testare combinazioni di farmaci per il trattamento di precisione di condizioni complesse o stati di malattie rare che richiedono cure personalizzate. Gli scienziati che svolgono ricerche di base per saperne di più sui fattori genetici e sui meccanismi molecolari all’opera nelle malattie che colpiscono il tratto digestivo saranno in grado di utilizzarli ordinando precursori sferoidi congelati per i loro esperimenti.
I laboratori che testano modi per coltivare organoidi più grandi per un potenziale trapianto otterrebbero forniture meno costose e più affidabili per la loro ricerca. E una nuova generazione di studenti di ricerca biomedica avrà un accesso molto più facile agli organoidi umani per studiare senza dover imparare a coltivare le iPSC.
Michael Helmrath, direttore della traduzione clinica per il Center for Stem Cell & Organoid Medicine (CuSTOM) presso Cincinnati Children’s, ha già iniziato a utilizzare materiali realizzati con il nuovo processo nella sua ricerca in corso per sviluppare tessuti intestinali trapiantabili: “Questo è un grande passo avanti per il campo su molti fronti”, ha affermato Helmrath: “Essere in grado di ridurre la complessità del processo e fornire rendimenti più elevati è vantaggioso per il nostro lavoro. E essere in grado di tradurre i metodi in altri laboratori aiuterà a far progredire la medicina rigenerativa”.
Jim Wells, Chief Scientific Officer di CuSTOM, ha coordinato la squadra di esperti che ha ottenuto il primo successo nella realizzazione di un organoide intestinale umano, pubblicato online nel 2010 su Nature: “Il lavoro guidato da Amy e Chris rappresenta un importante progresso per i nostri sforzi per sviluppare piattaforme ad alto rendimento per la scoperta di farmaci”, ha aggiunto Wells.
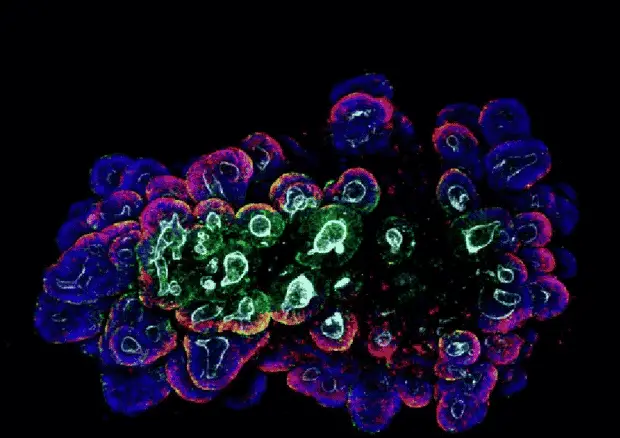
Oltre a Pitstick e Mayhew, i coautori di Cincinnati Children per questo studio includono Wells, Helmrath, Holly Poling, BS, Nambirajan Sundaram, Ph.D., Phillip Lewis, Ph.D., Daniel Kechele, Ph.D., J Guillermo Sanchez, Ph.D. candidato, Melissa Scott-Preusse, BS, e Taylor Broda, MBA.