I ricercatori dell‘UC Davis MIND durante una loro ricerca hanno utilizzato il sequenziamento genomico per trovare una firma di metilazione del DNA nella placenta dei neonati a cui è stato diagnosticato l’autismo. Questo segno distintivo è stato collegato al neurosviluppo fetale precoce. Grazie a questo studio è stato identificato un nuovo gene umano legato allo sviluppo del cervello fetale e al disturbo dello spettro autistico (ASD). La scoperta collega anche il gene all’uso precoce di vitamine prenatali da parte della madre e ai livelli di ossigeno placentare.
I risultati della ricerca sono stati pubblicati sulla rivista scientifica Genome Biology.
Placenta e indizi sul disturbo dello spettro autistico: ecco cosa dice la ricerca
“Adottando un approccio imparziale allo studio delle differenze di metilazione del DNA placentare, abbiamo scoperto un nuovo gene in una regione del genoma scarsamente mappata associata all’autismo“, ha affermato Janine LaSalle, autrice principale dello studio e professore di microbiologia e immunologia presso l’UC Davis Health.
L’ASD è una condizione neurologica complessa legata a fattori genetici ed ambientali. I Centri statunitensi per il controllo e la prevenzione delle malattie (CDC) stimano che a un bambino su 44 venga diagnosticato un ASD, molto più diffuso nei maschi rispetto alle femmine.
La placenta supporta lo sviluppo fetale nell’utero. Regola l’apporto di ossigeno e il metabolismo e fornisce ormoni e neurotrasmettitori fondamentali per lo sviluppo del cervello del feto.
“La placenta è un tessuto spesso frainteso e trascurato, nonostante la sua importanza nella regolazione e quindi nel riflettere eventi critici per lo sviluppo del cervello in utero. È come una capsula del tempo per trovare cose accadute nell’utero. Per decenni, le nascite in ospedale hanno gettato via le placente nonostante questo tessuto sia una miniera d’oro per trovare indizi molecolari sui risultati dei bambini“, ha spiegato LaSalle.
Durante la gravidanza, il feto potrebbe sperimentare stress ossidativo, uno squilibrio di radicali liberi e antiossidanti nel corpo. Questo è comune nel normale sviluppo del cervello. Tuttavia, in alcuni casi, l’esposizione a fattori ambientali come l’inquinamento atmosferico e i pesticidi può portare a un eccessivo stress ossidativo. Questo stato può portare a danni cellulari e tissutali o a un neurosviluppo ritardato.
“Lo stress ossidativo è normale. Ma lo stress ossidativo eccessivo può derivare da esposizioni ambientali legate all’ASD come inquinamento atmosferico, pesticidi, obesità materna e infiammazione“, ha affermato LaSalle.
L’epigenoma è un insieme di composti chimici e proteine che dicono al DNA cosa fare. Questi composti si attaccano al DNA e ne modificano la funzione. Uno di questi composti è CH3 (noto come il gruppo metilico) che porta alla metilazione del DNA. L’epigenoma neonatale può riflettere le interazioni passate tra fattori genetici e ambientali durante lo sviluppo iniziale. Può anche influenzare i futuri risultati di salute.
La placenta è un tessuto promettente per identificare i cambiamenti di metilazione del DNA nei geni che funzionano anche nel cervello fetale. Questo studio ha esaminato l’associazione dell’ASD con la metilazione del DNA placentare.
I ricercatori hanno studiato lo sviluppo di 204 bambini nati da madri iscritti agli studi MARBLES e EARLI. Queste madri avevano almeno un figlio più grande con autismo ed erano considerate con una maggiore probabilità di avere un altro figlio con ASD. Quando questi bambini sono nati, le placente delle madri sono state conservate per analisi future.
A 36 mesi, i bambini hanno ricevuto valutazioni diagnostiche e dello sviluppo. Sulla base di questi test, i ricercatori hanno raggruppato i bambini in “sviluppo tipico” (TD), “con ASD” e “sviluppo non tipico” (Non-TD).
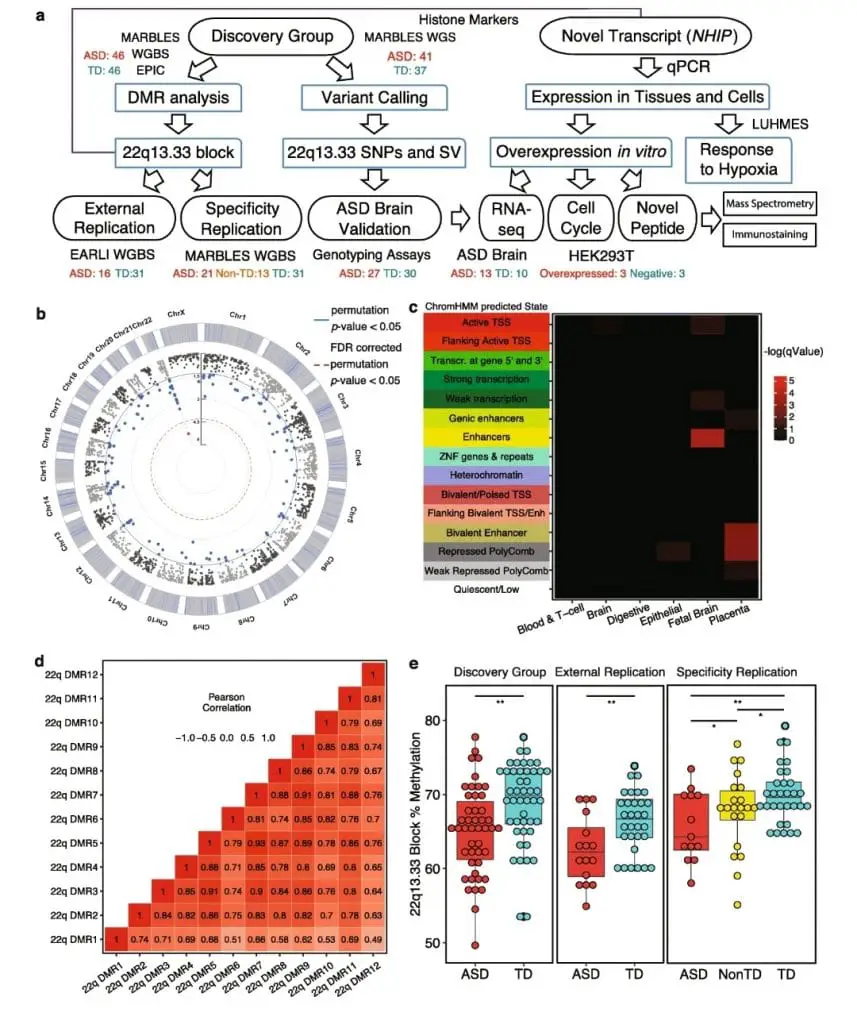
I ricercatori hanno anche estratto e quantificato il DNA dai tessuti della placenta. Hanno diviso i campioni di placenta in gruppi di scoperta, replicazione e replicazione della specificità.
Per il gruppo di scoperta, hanno diviso e sequenziato 92 campioni (46 ASD, 46 TD) dallo studio MARBLES utilizzando il sequenziamento del bisolfito dell’intero genoma (WGBS) e il sequenziamento dell’intero genoma (WGS). Per determinare se la metilazione differenziale fosse riproducibile in una popolazione diversa, il gruppo di replicazione includeva i dati WGBS da 16 campioni ASD e 31 TD dello studio EARLI.
Il gruppo di replicazione della specificità aveva 21 campioni di placenta ASD, 13 Non-TD e 31 TD dallo studio MARBLES. I ricercatori hanno utilizzato questi campioni per determinare se i cambiamenti di metilazione fossero specifici dell’ASD.
Infine, hanno eseguito il sequenziamento dell’intero genoma su 41 bambini ASD e 37 TD MARBLES.
I ricercatori hanno identificato un blocco di metilazione differenziale nell’ASD in 22q13.33, una regione nel cromosoma 22 non precedentemente collegata all’ASD. Hanno individuato e caratterizzato un nuovo gene noto come LOC105373085 all’interno di quella regione e lo hanno ribattezzato NHIP (ipossia neuronale inducibile, associata alla placenta).
Per comprendere la funzione di questo gene, hanno rilevato i livelli di espressione di NHIP nelle linee cellulari umane e nel tessuto cerebrale. Gli studiosi hanno testato la reattività di NHIP all’ipossia, uno stato di bassi livelli di ossigeno nei tessuti. I ricercatori hanno scoperto che NHIP è un gene che si attiva nei neuroni in seguito all’ipossia e regola altri percorsi genici con funzioni nello sviluppo neuronale e nella risposta allo stress ossidativo. Livelli più elevati di NHIP hanno aumentato la divisione cellulare in una linea cellulare embrionale.
Questo è importante perché nella placenta, l’ipossia innesca la divisione cellulare placentare per stabilire un ulteriore contatto con i vasi sanguigni materni per fornire abbastanza ossigeno per il cervello in via di sviluppo.
I ricercatori hanno anche scoperto che NHIP era meno attivato nella placenta e nel cervello ASD rispetto ai campioni di TD, supportando un ruolo protettivo per NHIP nella prevenzione dell’ASD.
“Abbiamo scoperto che il gene NHIP è attivo nel cervello, risponde allo stress ossidativo e influenza l’espressione di altri geni noti associati all’autismo“, ha specificato LaSalle. “Nella maggior parte delle gravidanze, la placenta sperimenta alcuni inevitabili livelli di stress. Pensiamo che il NHIP sia lì per tamponare gli effetti dell’eccessivo stress ossidativo“.
Un altro notevole risultato dello studio è stato il ruolo svolto dalle vitamine prenatali nella regolazione del lavoro del NHIP. Le vitamine prenatali sono ricche di acido folico e possono ridurre lo stress ossidativo.
L’uso prenatale di vitamine durante il primo mese di gravidanza ha mostrato un effetto protettivo significativo tra gli individui con differenze genetiche nella regione NHIP 22q13.33. L’assunzione di vitamine prenatali nel primo mese di gravidanza sembra fornire elementi metabolici essenziali per contrastare l’eredità genetica della ridotta reattività del NHIP allo stress ossidativo.
“In linea con studi precedenti, abbiamo scoperto che l’assunzione di una vitamina prenatale è essenziale quando si pianifica una gravidanza“, ha affermato LaSalle. “I risultati del nostro studio forniscono spunti chiave che possono aiutare a identificare i neonati con maggiori probabilità di sviluppare l’autismo e farli intervenire prima o semplicemente sapendo di guardarli prima“.
I ricercatori hanno sottolineato che questi risultati richiederanno un’ulteriore replica prima di essere utilizzati a livello diagnostico.
Certo che farei delle indagini, sono mamma di un bimbo autistico di 7 anni, p.