Gli scienziati dell’Università di Ginevra (UNIGE) hanno condotto analisi atomiche, molecolari e cellulari e, in una nuova ricerca, hanno dimostrato che una semplice molecola di zinco comunemente usata in altri contesti, potrebbe ripristinare, almeno in parte, il funzionamento della proteina coinvolta nelle mutazioni nel gene GNAO1, che sono causa di gravi e rare malattie genetiche, come le encefalopatie pediatriche di origine genetica.
I risultati dello studio sono stati pubblicati sulla rivista scientifica Science Advances.
Rare patologie genetiche derivate dalla mutazione del gene GNAO1 curate con lo zinco: è possibile?
I bambini con mutazioni del gene GNAO1 mostrano disturbi clinici significativi: ritardo dello sviluppo intellettivo e motorio, movimenti incontrollabili, nonché epilessia più o meno grave, talvolta accompagnata da danno cerebrale e atrofia. GNAO1 codifica per una proteina chiamata “Gαo” che è uno degli elementi costitutivi più essenziali delle cellule neuronali.
“Questa mutazione è eterozigote dominante, il che significa che una delle due copie del gene è funzionale e l’altra è mutata”, ha dichiarato Vladimir Katanaev, Professore presso il Dipartimento di Fisiologia e Metabolismo Cellulare presso la Facoltà di Medicina dell’UNIGE, che ha guidato questa ricerca: “Anche se i neuroni hanno la metà delle proteine normali, i risultati sullo sviluppo neurologico sono devastanti”.
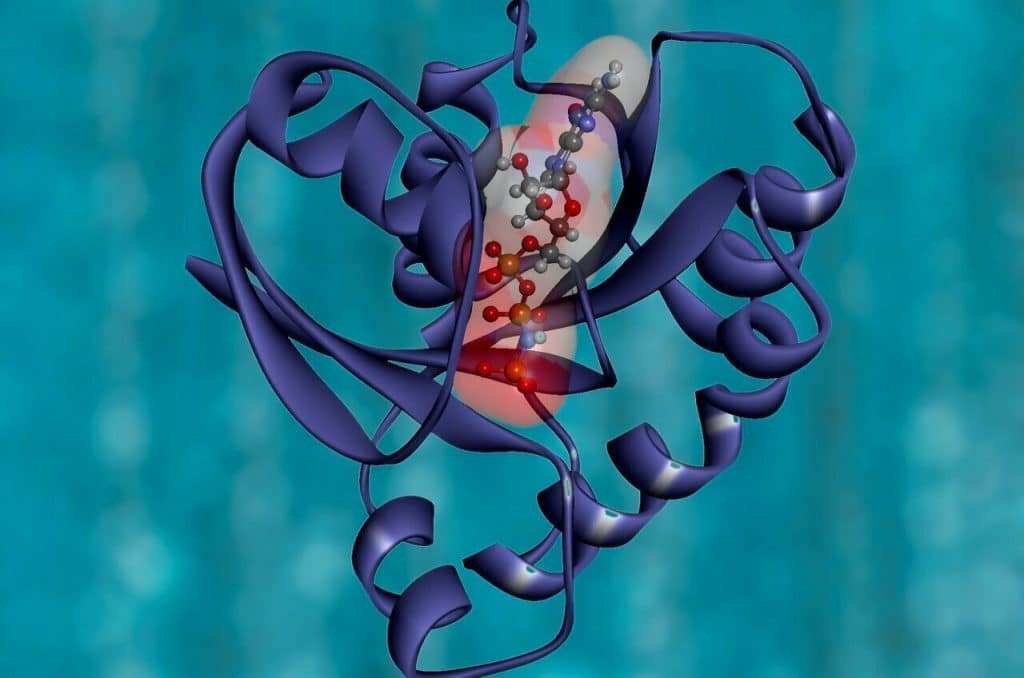
Le proteine Gαo funzionali vengono attivate quando sono legate al nucleotide chiamato GTP, quindi si disattivano attraverso l’idrolisi. Ciò consente alle proteine di seguire un ciclo di attivazione e disattivazione necessario per la funzione cellulare.
Le mutazioni nel gene GNAO1 portano alla sostituzione di un amminoacido in Gαo con un altro. Queste proteine mutate si attivano molto rapidamente, ma non sono in grado di effettuare l’idrolisi. Sono quindi intrappolati in uno stato di attivazione permanente.
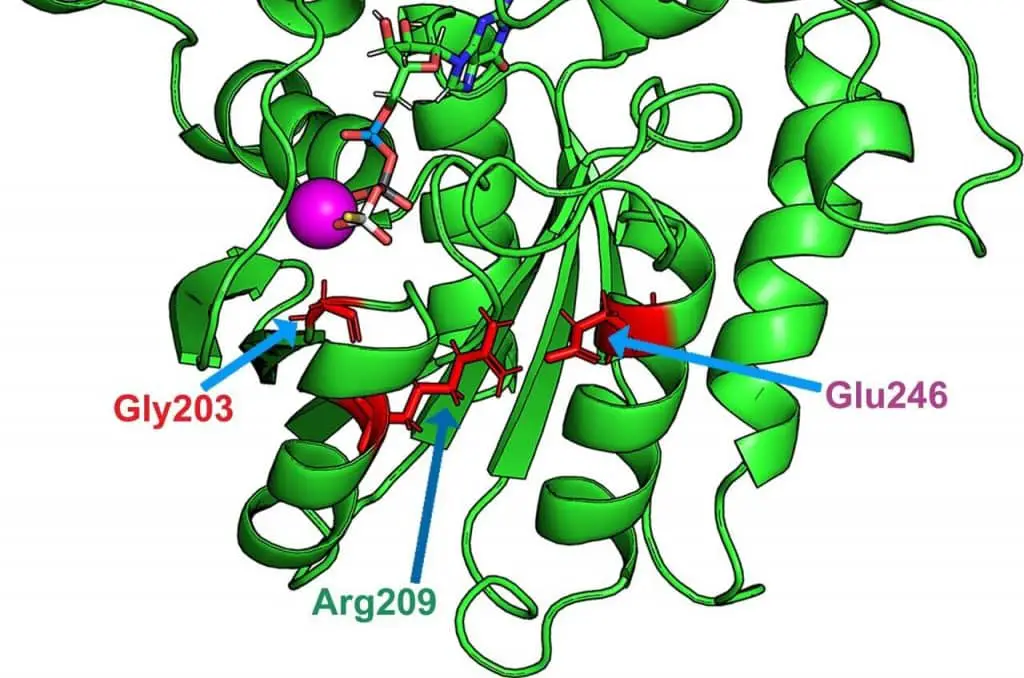
“Si scopre che queste mutazioni influenzano indirettamente un aminoacido cruciale per l’idrolisi del GTP: la glutammina 205. Normalmente, questa glutammina è strutturalmente situata di fronte al GTP, che consente l’idrolisi. Tuttavia, questa glutammina viene spostata in caso di mutazione patologica: questa distanza strutturale impedisce che questo meccanismo abbia luogo”, spiega Vladimir Katanaev.
Interrompendo le interazioni con le proteine della membrana cellulare, queste mutazioni modificano la capacità dei neuroni di comunicare con il loro ambiente. Gli scienziati hanno basato il resto del loro studio su questi primi risultati fondamentali. “In definitiva, il nostro obiettivo è cercare di trovare un trattamento che possa limitare i sintomi della malattia e migliorare la qualità della vita dei pazienti e delle loro famiglie”.
Per fare ciò, il team di ricerca ha eseguito uno screening ad alto rendimento di migliaia di farmaci approvati con l’idea di identificare una molecola in grado di riattivare l’idrolisi. “In effetti, nelle malattie rare, di solito non c’è modo di sviluppare una molecola completamente nuova. Il riutilizzo di molecole di farmaci già disponibili, approvate e sicure può invece essere una strategia di successo”, aggiunge Vladimir Katanaev.
Spicca una molecola, il piritione di zinco: corregge la perdita di interazioni intracellulari portando la glutammina 205 vicino alla sua normale posizione strutturale, consentendo l’idrolisi del GTP.
“Questo è un vecchio farmaco antimicotico e antibatterico utilizzato sotto forma di crema per alcune malattie della pelle. Abbiamo fatto un ulteriore passo avanti nell’analisi per vedere se tutta o parte di questa molecola fosse efficace. Si scopre che è lo ione zinco che è efficace qui Molto facile da trovare in qualsiasi farmacia, è già approvato per il trattamento della depressione lieve, dell’insonnia e persino di alcuni disturbi dello sviluppo nei bambini”, afferma Vladimir Katanaev.

Per confermare questo risultato, il team di ricerca ha utilizzato un modello animale innovativo: la mosca della Drosophila. “Abbiamo modificato il genoma delle mosche per replicare la mutazione del gene GNAO1, conservando una copia normale del gene come negli esseri umani”, spiega Mikhail Savitskiy, ricercatore nel laboratorio di Vladimir Katanaev e specialista nella modellazione delle malattie in Drosophila.
“Le mosche avevano problemi di mobilità e una durata della vita ridotta”. Tuttavia, l’aggiunta di zinco alla loro dieta per tutta la vita, dalla fase larvale in poi, ha permesso loro di eliminare quasi completamente questi sintomi. “Questo risultato è davvero sorprendente, soprattutto perché lo zinco è una sostanza molto sicura, ben tollerata ed economica”. I primi studi sui pazienti sembrano promettenti; Verranno ora avviati studi clinici per valutare se un miglioramento può essere misurato a lungo termine.
Anche gli scienziati della Scripps Research hanno chiarito il funzionamento della misteriosa proteina chiamata Gαo, che è una delle proteine più abbondanti nel cervello e, se mutata, provoca gravi disturbi del movimento, portandoli a fare nella comprensione di base di come il cervello controlla i muscoli e potrebbero portare a trattamenti per i bambini nati con disturbi del movimento di mutazione Gαo.
Tali condizioni, note come disturbi dello sviluppo neurologico correlati a GNAO1, sono state scoperte solo nell’ultimo decennio e si pensa che colpiscano almeno centinaia di bambini in tutto il mondo. I bambini con la malattia soffrono di gravi ritardi nello sviluppo, convulsioni e movimenti muscolari incontrollati.
“Siamo stati in grado di capire cosa fa questa proteina nel sistema nervoso e quindi utilizzare tale conoscenza per scoprire perché la sua mutazione porta a questo disturbo devastante”, afferma l’autore senior dello studio Kirill Martemyanov, Ph.D., professore e presidente di il Dipartimento di Neuroscienze presso Scripps Research in Florida.
Gαo è un membro di una famiglia di proteine chiamate proteine G, meglio conosciute per il loro ruolo nel trasportare segnali nelle cellule dai recettori della superficie cellulare chiamati recettori accoppiati a proteine G (GPCR). Questi recettori si trovano su molti tipi di cellule nel cervello e in altre parti del corpo e mediano dozzine di processi biologici dall’infiammazione all’umore e alla vista.
Poiché i GPCR sono così importanti e relativamente ben studiati, una grande parte dei farmaci li mira a curare le malattie. Tuttavia, a differenza della maggior parte delle altre proteine G, Gαo ha un ruolo nella segnalazione GPCR che è rimasto alquanto oscuro.

“Il mio laboratorio ha studiato questa proteina per un po’ di tempo”, dice Martemyanov, “e non c’era davvero alcun collegamento con nulla di immediatamente correlato alla malattia fino a pochi anni fa, quando si scoprì che le mutazioni nel gene che codifica per Gαo causavano una serie di sindromi genetiche rare caratterizzate da convulsioni e movimenti incontrollabili”.
Il neuroscienziato ha presto partecipato agli incontri della Bow Foundation con sede in Virginia e dell’organizzazione europea Famiglie GNAO1, che sostengono le famiglie dei bambini con queste sindromi. In definitiva, la Bow Foundation ha contribuito a finanziare il suo studio attraverso un premio di borsa di studio al primo autore dello studio Brian Muntean, Ph.D., un ricercatore post-dottorato nel laboratorio Martemyanov.
Gli scienziati della Scripps Research hanno chiarito il funzionamento di una misteriosa proteina chiamata Gαo, che è una delle proteine più abbondanti nel cervello e, se mutata, provoca gravi disturbi del movimento.
I risultati sono un progresso nella comprensione di base di come il cervello controlla i muscoli e potrebbero portare a trattamenti per i bambini nati con disturbi del movimento di mutazione Gαo. Tali condizioni, note come disturbi dello sviluppo neurologico correlati a GNAO1, sono state scoperte solo nell’ultimo decennio e si pensa che colpiscano almeno centinaia di bambini in tutto il mondo. I bambini con la malattia soffrono di gravi ritardi nello sviluppo, convulsioni e movimenti muscolari incontrollati.
“Siamo stati in grado di capire cosa fa questa proteina nel sistema nervoso e quindi utilizzare tale conoscenza per scoprire perché la sua mutazione porta a questo disturbo devastante”, afferma l’autore senior dello studio Kirill Martemyanov, Ph.D., professore e presidente di il Dipartimento di Neuroscienze presso Scripps Research in Florida
Gαo è un membro di una famiglia di proteine chiamate proteine G, meglio conosciute per il loro ruolo nel trasportare segnali nelle cellule dai recettori della superficie cellulare chiamati recettori accoppiati a proteine G (GPCR). Questi recettori si trovano su molti tipi di cellule nel cervello e in altre parti del corpo e mediano dozzine di processi biologici dall’infiammazione all’umore e alla vista.
Poiché i GPCR sono così importanti e relativamente ben studiati, una grande parte dei farmaci li mira a curare le malattie. Tuttavia, a differenza della maggior parte delle altre proteine G, Gαo ha un ruolo nella segnalazione GPCR che è rimasto alquanto oscuro.
“Il mio laboratorio ha studiato questa proteina per un po’ di tempo”, dice Martemyanov, “e non c’era davvero alcun collegamento con nulla di immediatamente correlato alla malattia fino a pochi anni fa, quando si scoprì che le mutazioni nel gene che codifica per Gαo causavano una serie di sindromi genetiche rare caratterizzate da convulsioni e movimenti incontrollabili”.
Il neuroscienziato ha presto partecipato agli incontri della Bow Foundation con sede in Virginia e dell’organizzazione europea Famiglie GNAO1, che sostengono le famiglie dei bambini con queste sindromi. In definitiva, la Bow Foundation ha contribuito a finanziare il suo studio attraverso un premio di borsa di studio al primo autore dello studio Brian Muntean, Ph.D., un ricercatore post-dottorato nel laboratorio Martemyanov.
La proteina Gαo si trova ad alti livelli nelle cellule cerebrali e le sindromi causate dalla mutazione del suo gene, GNAO1, comportano interruzioni nella segnalazione cerebrale che controlla i movimenti. Pertanto, nello studio, Martemyanov e colleghi si sono concentrati sul ruolo di Gαo in un importante hub di controllo motorio nel cervello chiamato striato.
Hanno scoperto che i topi ingegnerizzati con un gene GNAO1 interrotto nei neuroni striatali presentavano un grave disturbo del movimento, con compromissione della coordinazione muscolare e della loro capacità di apprendere compiti fisici. Confrontando quei topi con le loro controparti sane, i ricercatori hanno preso in giro i complessi meccanismi molecolari con cui Gαo influenza la segnalazione GPCR in queste cellule cerebrali.
Questi neuroni striatali esprimono GPCR per i neurotrasmettitori dopamina e adenosina e gli scienziati sono stati in grado di dimostrare che Gαo supporta gli elementi chiave delle vie di segnalazione che alimentano i neuroni striatali da questi recettori, aiutando a mantenere la corretta amplificazione e coordinazione dei segnali della dopamina e dell’adenosina e consentendo un controllo continuo dei movimenti.
Il team ha progettato topi per avere molte delle stesse mutazioni GNAO1 che sono state riportate nei bambini con disturbi GNAO1. Gli scienziati hanno scoperto che queste mutazioni potevano essere classificate in base a una serie di carenze, ma in ogni caso il mutante risultante Gαo non era del tutto funzionale.
I disturbi GNAO1 di solito coinvolgono solo una copia mutante del gene delle due copie che esistono nel genoma di ogni persona. Martemyanov e colleghi hanno scoperto, tuttavia, che le proteine Gαo mutanti spesso interferiscono con il funzionamento delle restanti proteine Gαo non mutanti, ciò che i biologi chiamano un effetto “negativo dominante”. Gli scienziati hanno anche scoperto che questa interferenza assume forme diverse a seconda della particolare mutazione GNAO1, creando una varietà di modelli patologici, ma in genere sembra causare gravi interruzioni del controllo motorio anche quando è presente la normale copia funzionale di Gαo.
“Questi risultati possono ora guidare il nostro pensiero su possibili strategie correttive”, afferma Martemyanov.

Vincenzo Leuzzi, professore di Neuropsichiatria all’Università La Sapienza di Roma, Responsabile della UOC di Neuropsichiatria Infantile presso il Policlinico Umberto I, ha dichiarato: “Il coinvolgimento del gene GNAO1 in una grave encefalopatia epilettica ad esordio precoce è stato scoperto recentemente, nel 2013, da un gruppo di ricerca giapponese. Questo gene è stato quindi inserito nei pannelli di geni che vengono esaminati in modo in tutti i bambini che presentano forme gravi di epilessia ad esordio precoce non riconducibili a cause acquisite. Si tratta di bambini che spesso presentano anche ritardo psicomotorio ed altri sintomi neurologici”.
“Utilizzando questi pannelli, si è trovato che le alterazioni di questo gene potevano causare forme più lievi di epilessia, o anche non essere associate ad epilessia, ma piuttosto ritardo psicomotorio e movimenti involontari di tipo coreico ad esordio nei primi anni di vita”.
“I movimenti coreici sono movimenti involontari rapidi, caotici e talora anche molto ampi e spesso fortemente disabilitanti. Nei bambini affetti da mutazione del gene GNAO1 si manifestano spesso in forma parossistica per la durata a volte anche di alcune ore e si alternano a fasi di tranquillità o assoluta mancanza di motilità. Questi movimenti possono diventare così continui ed intensi da determinare una sofferenza delle fibre muscolari dalle quali fuoriescono enzimi e proteine che possono determinare un danno renale secondario anche molto grave ed acuto”, ha continuato Leuzzi.
“Il gene GNAO1 è molto importante, perché produce una proteina, la proteina G, che ha un ruolo fondamentale nel mediare gli effetti della trasmissione del segnale nelle cellule nervose. Si tratta di una famiglia di proteine che veicola segnali intracellulari il cui significato e le cui conseguenze variano in funzione del tessuto. Ad esempio, alcune di queste proteine sono implicate in alcuni specifici meccanismi dell’oncogenesi”, ha aggiunto il Professore.
“Ci sono molte ricerche in corso su questa famiglia di proteine, anche se non specificamente connesse alla mutazione del gene GNAO1. Siamo per ora in una situazione di malattia relativamente rara con ancora limitate prospettive sul piano terapeutico. Si tratta inoltre di un contesto biologico tutt’altro che semplice, perché si deve agire sui meccanismi di comunicazione intracellulare non facilmente approcciabili dal punto di vista terapeutico. In questo momento, si stanno studiando alcuni modelli preclinici per poi capire come trasferire possibili ipotesi terapeutiche in un ambito più strettamente clinico”.
“In generale, si ha l’impressione di non essere di fronte a una malattia degenerativa. Piuttosto si tratta di una condizione stabile nel tempo sebbene con un importante quadro di disabilità nella maggior parte dei bambini affetti”, ha spiegato Leuzzi.
‘Il disturbo del movimento specifico della forma sembra rispondere bene a un farmaco, la tetrabenazina, già utilizzato con successo in altri disturbi del movimento. Nelle forme più gravi della malattia, sembra essere efficace l’adozione di stimolatori cerebrali profondi, a livello dei gangli della base e del pallido. Si tratta di una sorta di pacemaker, che con la propria azione a bassissimo voltaggio è in grado di moderare o talvolta ridurre significativamente la frequenza e l’intensità dei movimenti involontari”.

“Sono stati riportati diversi casi in letteratura, tutti con esito positivo. Si tratta ovviamente di terapie sintomatiche, non eziologiche. Aumentando il numero di pazienti e col migliorare della terapia genica, si potranno aprire nuove prospettive terapeutiche per il futuro. È importante che i genitori di questi bambini ‘rari’ si tengano in contatto e lavorino con i centri ove sono seguiti, e che ci sia una rete integrata di interventi terapeutici in cui quello riabilitativo ha tuttora un ruolo centrale”, ha concluso Leuzzi.