Una ricerca innovativa sta emergendo nel campo delle neuroscienze, suggerendo un approccio terapeutico inedito per la malattia di Alzheimer, incentrato sulla modulazione dell’attività delle cellule immunitarie residenti nel cervello, la microglia. Lo studio in questione pone in risalto il ruolo centrale della noradrenalina, una molecola che funge sia da ormone che da neurotrasmettitore, nell’orchestrare la risposta infiammatoria cerebrale.
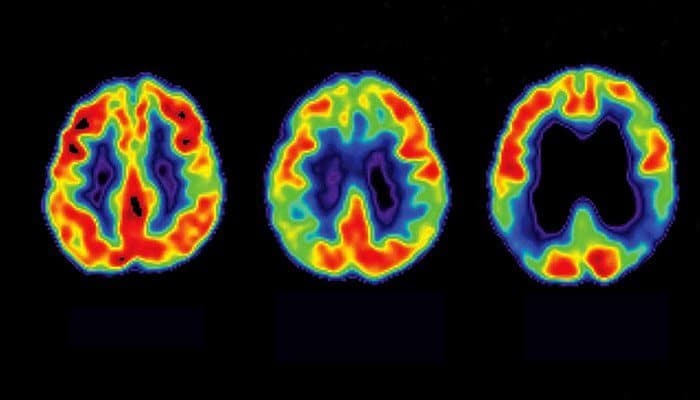
Noradrenalina: una potenziale strategia terapeutica precoce per la malattia di Alzheimer
Questa nuova comprensione dei meccanismi patogenetici dell’Alzheimer potrebbe spianare la strada allo sviluppo di trattamenti più selettivi, da intraprendere nelle fasi prodromiche della malattia e personalizzati in base alle specifiche esigenze di ciascun individuo affetto. L’obiettivo primario di tale strategia terapeutica consisterebbe nel prevenire o attenuare l’infiammazione cronica e dannosa che si osserva tipicamente nel cervello dei pazienti affetti da Alzheimer, considerata un fattore chiave nella progressione della neurodegenerazione.
La noradrenalina, come evidenziato dalla Dottoressa Ania Majewska, Ph.D., del Del Monte Institute for Neuroscience dell’Università di Rochester e autrice principale dello studio, riveste un ruolo di primaria importanza nella segnalazione cerebrale, esercitando la sua influenza su una vasta gamma di tipi cellulari presenti nel tessuto nervoso. Nel contesto specifico delle malattie neurodegenerative, tra cui spicca la malattia di Alzheimer, la noradrenalina ha dimostrato di possedere intrinseche proprietà antinfiammatorie.
Questa osservazione suggerisce che l’alterazione dei livelli o della segnalazione della noradrenalina potrebbe contribuire alla disregolazione della risposta immunitaria nel cervello dei pazienti affetti da queste patologie. Pertanto, comprendere appieno i meccanismi attraverso i quali la noradrenalina interagisce con le cellule immunitarie cerebrali potrebbe rivelarsi fondamentale per lo sviluppo di interventi terapeutici mirati.
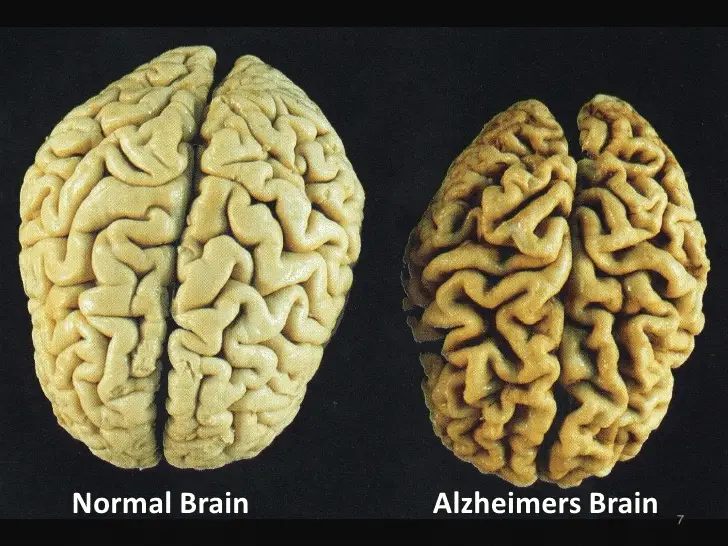
L’innovativo studio condotto dal team della Dottoressa Majewska descrive in dettaglio come il potenziamento dell’azione della noradrenalina specificamente sulla microglia, la popolazione di cellule immunitarie residenti nel cervello, possa effettivamente attenuare i primi segni di infiammazione e i conseguenti danni neuronali osservati in modelli preclinici della malattia di Alzheimer.
La microglia svolge un ruolo complesso e dinamico nel cervello, agendo sia come sentinella immunitaria che come mediatrice di processi neuroinfiammatori. In condizioni patologiche come l’Alzheimer, la microglia può assumere uno stato di iperattivazione cronica, contribuendo all’infiammazione dannosa che danneggia i neuroni e sinapsi. I risultati di questa ricerca suggeriscono che modulare l’attività della microglia attraverso il potenziamento della segnalazione noradrenergica potrebbe rappresentare una strategia terapeutica precoce efficace per contrastare i processi neurodegenerativi alla base della malattia di Alzheimer.
Questa nuova prospettiva apre la strada a interventi terapeutici che mirano a ristabilire l’equilibrio immunologico nel cervello, intervenendo nelle fasi iniziali della patologia per rallentarne o addirittura prevenirne la progressione.
Dissezionare l’interazione tra immunità cerebrale, infiammazione e noradrenalina
Una rigorosa indagine preclinica, condotta su modelli murini affetti da patologia simile all’Alzheimer, ha visto la sinergica collaborazione di due distinti laboratori di ricerca, unendo competenze complementari nell’esplorazione del complesso ruolo del sistema immunitario intrinseco al cervello e nella delucidazione dei meccanismi infiammatori che sottendono la neurodegenerazione caratteristica della malattia di Alzheimer.
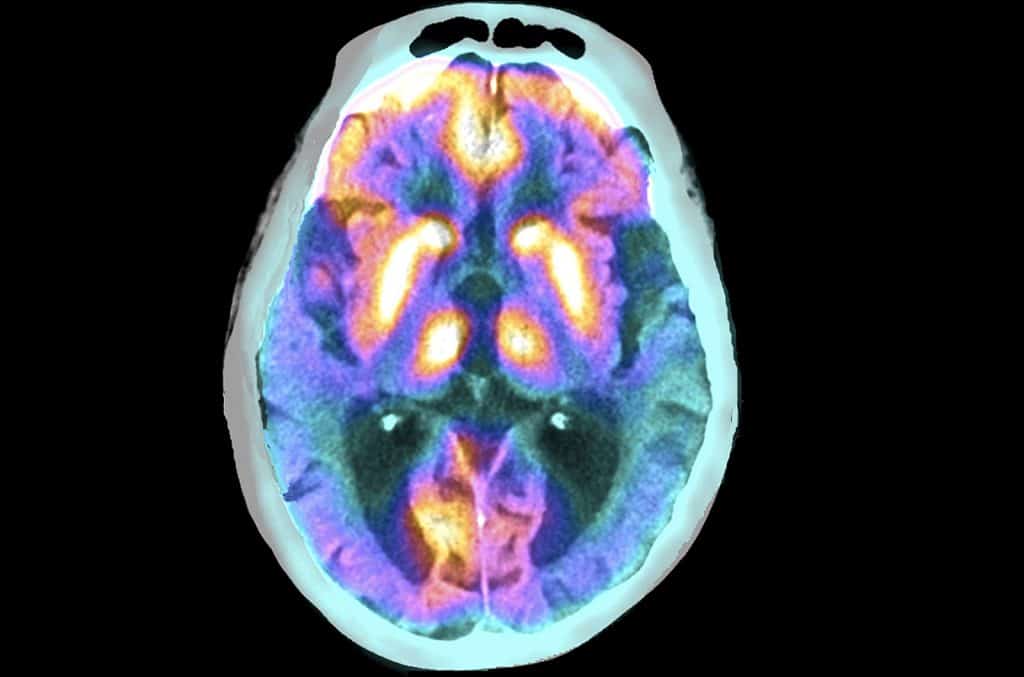
Sotto la guida di Linh Le, Ph.D., uno studente di dottorato con affiliazioni presso entrambi i gruppi di ricerca, lo studio si è focalizzato in modo specifico sulla noradrenalina, un neurotrasmettitore e ormone endogeno noto per la sua capacità di modulare la risposta infiammatoria a livello cerebrale. L’obiettivo primario di questa ricerca congiunta è stato quello di chiarire il ruolo preciso della noradrenalina nell’influenzare l’attività della microglia, le cellule immunitarie residenti nel parenchima cerebrale, nel contesto della patologia alzheimeriana.
Nel microambiente cerebrale fisiologico, la microglia svolge un ruolo cruciale nel mantenimento dell’omeostasi, agendo attivamente nella sorveglianza immunitaria e nella rimozione di detriti cellulari. Queste cellule immunitarie esprimono sulla loro superficie un recettore specifico denominato recettore β2-adrenergico (β2AR), il quale funge da vero e proprio interruttore molecolare. L’attivazione di questo recettore da parte della noradrenalina innesca una cascata di segnalazione intracellulare che indirizza la microglia verso una risposta antinfiammatoria, contribuendo attivamente alla risoluzione di eventuali stati infiammatori transitori e al mantenimento di un ambiente cerebrale equilibrato.
Nel contesto della malattia di Alzheimer e con il fisiologico processo di invecchiamento cerebrale, si osserva una progressiva diminuzione dell’attività di questo “interruttore calmante” rappresentato dal recettore β2AR, in particolare nelle regioni cerebrali dove si verifica l’accumulo patologico di aggregati proteici neurotossici noti come placche amiloidi. La formazione e la progressiva deposizione di queste placche amiloidi sembrano innescare un processo di disfunzione microgliale.
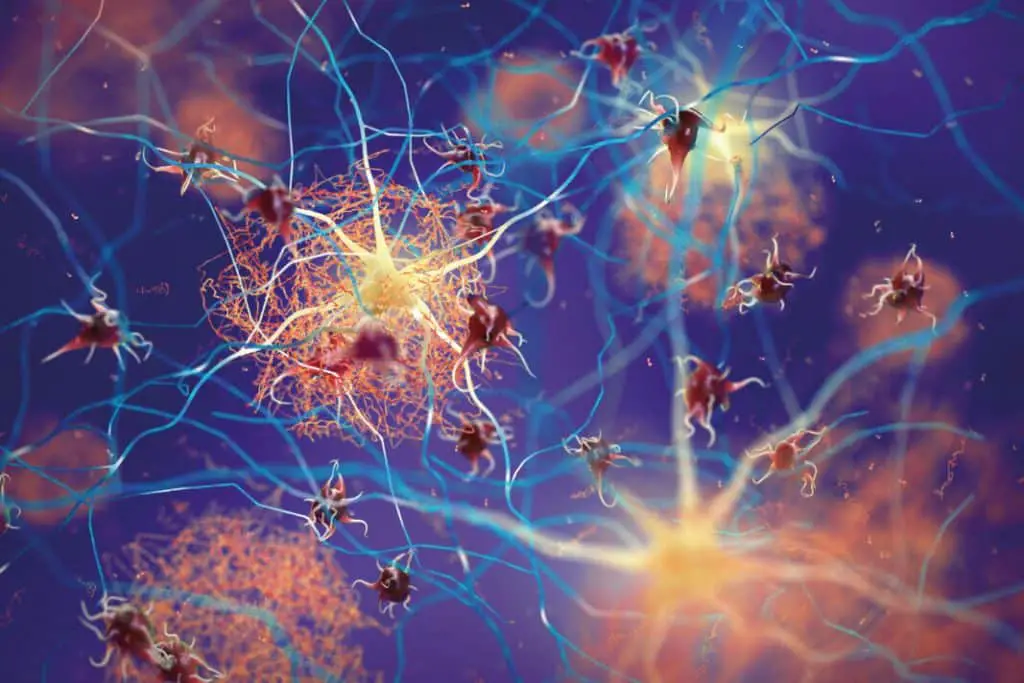
La microglia che si trova nelle immediate vicinanze di queste placche tende a perdere una quantità significativa di recettori β2AR funzionali, rendendo sempre più difficoltoso per queste cellule immunitarie rispondere efficacemente alla noradrenalina e, di conseguenza, contrastare l’insorgenza e la persistenza dell’infiammazione cronica associata alla malattia. Questo deficit nella segnalazione noradrenergica microgliale contribuisce all’instaurarsi di un circolo vizioso neuroinfiammatorio che alimenta ulteriormente la neurodegenerazione.
Per chiarire ulteriormente il ruolo causale del recettore β2AR microgliale nella patogenesi dell’Alzheimer, gli scienziati hanno intrapreso manipolazioni genetiche e farmacologiche in modelli murini. La rimozione genetica o il blocco farmacologico del recettore β2AR ha esacerbato significativamente la patologia cerebrale, manifestandosi con un aumento del carico di placche amiloidi, una maggiore intensità dell’infiammazione neurogliale e un incremento dei danni a carico delle cellule cerebrali.
Al contrario, la stimolazione farmacologica o il potenziamento dell’attività del recettore β2AR hanno prodotto effetti protettivi, riducendo il carico patologico e attenuando i segni di neuroinfiammazione. È di particolare interesse notare che l’efficacia di queste manipolazioni sperimentali sembra essere influenzata da fattori biologici intrinseci, come il sesso degli animali utilizzati nei modelli preclinici, e dalla tempistica dell’intervento terapeutico, suggerendo l’importanza di considerare la finestra temporale ottimale per eventuali future applicazioni cliniche.
Il ruolo primario della disregolazione microgliale mediata dalla noradrenalina nelle fasi precoci della malattia
Tradizionalmente, la malattia di Alzheimer è stata concettualizzata prevalentemente come una patologia neurodegenerativa innescata primariamente dal danno diretto alle cellule cerebrali, conseguente all’accumulo progressivo di aggregati proteici anomali, in particolare le placche amiloidi e i grovigli neurofibrillari di proteina tau iperfosforilata. Tuttavia, il presente studio introduce una prospettiva innovativa e potenzialmente rivoluzionaria, suggerendo che la perdita della fisiologica azione antinfiammatoria esercitata dalla noradrenalina sulla microglia potrebbe rappresentare un fattore patogenetico chiave nell’esacerbazione della malattia di Alzheimer.
È cruciale sottolineare che questa disfunzione immunitaria cerebrale potrebbe manifestarsi e contribuire significativamente alla progressione della malattia anche nelle fasi precliniche, antecedenti all’insorgenza di un danno neuronale esteso e clinicamente conclamato. Questa riconsiderazione del paradigma patogenetico pone l’accento sul ruolo attivo e precoce della disregolazione immunitaria cerebrale, in particolare della disfunzione microgliale, come motore primario della neurodegenerazione alzheimeriana.
I risultati di questa ricerca forniscono inoltre indicazioni cruciali sulla tempistica ottimale per l’intervento terapeutico. L’osservazione che i deficit nella segnalazione del recettore β2-adrenergico (β2AR) sulla microglia potrebbero insorgere molto precocemente nel corso del processo patologico suggerisce che future strategie terapeutiche potrebbero rivelarsi più efficaci se implementate nelle fasi prodromiche o addirittura pre-sintomatiche della malattia, piuttosto che attendere la comparsa di un danno neuronale significativo e irreversibile.
Intervenire precocemente sulla disfunzione microgliale, ripristinando la sua capacità di rispondere alla noradrenalina con una risposta antinfiammatoria fisiologica, potrebbe rappresentare una strategia per rallentare o addirittura prevenire la progressione della neurodegenerazione.
Considerando che l’attivazione farmacologica del recettore β2AR sulla microglia ha dimostrato di ridurre l’accumulo di placche amiloidi e di attenuare l’infiammazione neurogliale nei modelli preclinici, questo recettore emerge come un target terapeutico di primaria importanza per lo sviluppo di farmaci innovativi. Future terapie potrebbero essere specificamente progettate per modulare l’attività del β2AR microgliale, potenziando la capacità di queste cellule immunitarie di mantenere uno stato funzionale antinfiammatorio e neuroprotettivo.
In tal modo, si potrebbe mirare a rallentare o addirittura modificare il decorso naturale della malattia di Alzheimer. Tuttavia, la ricerca evidenzia anche la potenziale necessità di personalizzare tali trattamenti in base alle caratteristiche individuali di ciascun paziente. La variabilità osservata nella risposta al trattamento in funzione di fattori come il sesso biologico e lo stadio di progressione della malattia sottolinea l’importanza di un approccio terapeutico di precisione, che tenga conto della complessità e dell’eterogeneità della patologia alzheimeriana.
Oltre agli autori principali già citati, è doveroso riconoscere il contributo fondamentale degli altri coautori di questa importante ricerca: Alexis Feidler, Lia Calcines Rodriguez, MacKenna Cealie, Elizabeth Plunk, Herman Li, Kallam Kara-Pabani, Cassandra Lamantia e Kerry O’Banion, tutti afferenti al Del Monte Institute for Neuroscience. Il loro impegno congiunto e la loro expertise multidisciplinare hanno reso possibile l’approfondimento di questa complessa interazione tra sistema immunitario cerebrale e malattia di Alzheimer, aprendo nuove e promettenti prospettive per la comprensione e il trattamento di questa devastante malattia neurodegenerativa.
Lo studio è stato pubblicato sulla rivista Brain, Behavior, and Immunity.