Secondo il modello comunemente accettato, la malattia di Alzheimer è caratterizzata da una sequenza ineluttabile, dall’accumulo di proteine tossiche nel cervello alla demenza derivante dalla neurodegenerazione. (1)
Sebbene questa sequenza deterministica a volte sia vera, non sembra essere il caso per tutti i pazienti. Inoltre, i deludenti risultati dei farmaci di recente commercializzazione hanno evidenziato la necessità di riconsiderare questa malattia, che colpisce quasi 10 milioni di persone in Europa.
Un consorzio europeo di medici e scienziati, guidato dall’Università di Ginevra (UNIGE) e dagli ospedali universitari di Ginevra (HUG), in Svizzera, che comprende anche INSERM in Francia, ha analizzato i dati presentati in quasi 200 studi precedentemente pubblicati.
Lontano dall’essere una malattia monolitica in cui le stesse cause producono gli stessi effetti, questa analisi propone una categorizzazione dei pazienti in tre gruppi, ciascuno con le proprie dinamiche. Inoltre, il team di ricerca chiede un maggiore impegno per lo screening delle persone a rischio, al fine di attuare misure preventive il prima possibile.
Questo lavoro, pubblicato sulla rivista scientifica Nature Reviews Neuroscience, propone un profondo cambiamento di paradigma nel modo in cui viene compresa la malattia di Alzheimer.
Malattia di Alzheimer: ecco perché bisogna rivalutarla
La malattia di Alzheimer è solitamente descritta come una sequenza di quattro fasi: un deposito di amiloide appare nella corteccia cerebrale, quindi la proteina tau iperfosforilata aumenta e si aggrega nei neuroni. Di conseguenza, queste dinamiche causano neurodegenerazione e infine declino cognitivo, con perdita di memoria come primo sintomo.
Il primo farmaco mirato alla deposizione di placche amiloidi nel cervello, approvato pochi mesi fa dalle autorità regolatorie europee e americane, si è invece rivelato relativamente deludente: “Eppure, se consideriamo la malattia di Alzheimer come una cascata sequenziale di eventi biologici, avrebbe dovuto essere molto più efficace“, spiega Giovanni Frisoni, Professore del Dipartimento di Riadattamento e Geriatria della Facoltà di Medicina dell’UNIGE e Direttore del Centro della Memoria HUG , che ha diretto questo lavoro.
“Interrompere la produzione di beta-amiloide con un farmaco dovrebbe logicamente interrompere la perdita neuronale e quindi la perdita di memoria, che non è stata osservata in modo massiccio. Inoltre, abbiamo scoperto che alcune persone con amiloide non sviluppano sintomi cognitivi”, ha continuato Frisoni.
Per capire meglio perché il modello deterministico della malattia si trova in alcuni casi ma non in altri, gli scienziati hanno condotto una revisione sistematica della letteratura, alcuni articoli tendono a confermare questo modello, mentre altri lo confutano.
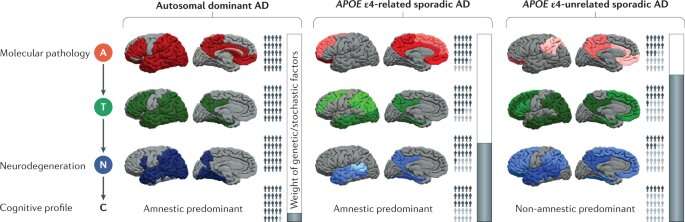
“Il nostro quadro interpretativo ha mostrato che la malattia di Alzheimer è più complessa di quanto appaia“, continua Daniele Altomare, ricercatore del gruppo di Giovanni Frisoni, che ha partecipato a questo lavoro. “Si possono distinguere tre gruppi di pazienti in base ai loro fattori di rischio, alle caratteristiche della loro malattia e al loro destino clinico”.
Pertanto, la previsione a cascata è confermata solo in uno di questi tre gruppi, in cui i pazienti portano una mutazione genetica ereditaria nota come “autosomica dominante“. Fortunatamente, questa mutazione è rara, poiché porta allo sviluppo sistematico di un deficit cognitivo precoce (tra i 30 ei 50 anni di età).
Nella forma sporadica, lo sviluppo dei sintomi del deficit cognitivo differisce a seconda della presenza o meno di una variazione genetica, l’allele e4 del gene APOE, che risulta essere un importante fattore di rischio: due terzi dei portatori infatti si svilupperanno, prima o poi in seguito, i sintomi della malattia di Alzheimer.
Il terzo gruppo è costituito da persone senza mutazione genetica associata per le quali la presenza di proteine neurotossiche sembra essere un fattore di rischio importante ma non unico: “La metà dei nostri pazienti appartiene a questo terzo gruppo“, sottolinea Giovanni Frisoni. “Il nostro modello probabilistico suggerisce quindi che tutti i fattori di rischio genetici e ambientali dovrebbero essere considerati. Il deterioramento cognitivo si sviluppa quando il loro peso supera la resilienza del cervello, che è a sua volta determinata da fattori protettivi di origine genetica e ambientale”.
Nel caso di pazienti con malattie cardiovascolari, la prevenzione dei rischi (ipertensione, obesità, ecc.) in persone che non hanno mai avuto un infarto o un ictus comporta una riduzione molto significativa del numero di casi negli anni successivi. Al contrario, tale trattamento dopo un ictus o un infarto porta solo minimi benefici in termini di recupero: “Secondo noi, lo stesso ragionamento dovrebbe valere per la malattia di Alzheimer: è essenziale curare le persone a rischio prima che compaiano i sintomi”.
L’identificazione delle persone a rischio ha finora richiesto procedure costose e invasive come la tomografia a emissione di positroni (PET) e le punture lombari. Ma il recente sviluppo di strumenti in grado di rilevare la presenza di beta-amiloide e tau iperfosforilata nel sangue sta per cambiare questa situazione e potrebbe consentire l’inclusione di tale screening nei controlli di routine.
“Anche se la gestione del paziente non cambierà durante la notte, una comprensione più dettagliata dei meccanismi biologici durante il lavoro renderà possibile sviluppare protocolli di ricerca più precise che tengano conto delle diverse forme della malattia di Alzheimer”, affermano gli autori.
Questa analisi è in linea con il lavoro svolto dal professor Bruno Dubois presso l‘INSERM, coautore di questo studio, finalizzato all’applicazione di precisi criteri diagnostici clinici. “Negli anni a venire, speriamo di adattare la prevenzione e strategie terapeutiche a ciascun individuo, piuttosto che secondo un protocollo standardizzato che ha già mostrato i suoi limiti”.