Una scoperta del team di Simona Stäger potrebbe aiutare a trovare una cura per la forma più grave di leishmaniosi. La leishmaniosi è una malattia tropicale che colpisce un numero crescente di persone in tutto il mondo. Ogni anno vengono segnalati tra 700.000 e 1 milione di nuovi casi.
I risultati della ricerca sono stati pubblicati sulla rivista Cell Reports.
Le cause della leishmaniosi
Causata da un protozoo parassita del genere Leishmania, che si trasmette all’uomo attraverso la semplice puntura di un flebotomo, la leishmaniosi comprende tre forme cliniche, di cui la forma viscerale è la più grave.
La professoressa Stäger dell’Institut national de la recherche scientifique (INRS) e il suo team, in collaborazione con altri ricercatori dell’INRS e dell’Università McGill, hanno osservato un sorprendente meccanismo immunitario legato alla leishmaniosi viscerale cronica.
Questa scoperta potrebbe essere un passo importante verso un nuovo approccio terapeutico a questa malattia.
In molte infezioni, le cellule T CD4 svolgono un ruolo chiave nella difesa dell’organismo colpito. Purtroppo, nel caso di infezioni croniche come la leishmaniosi, il mantenimento del numero di cellule CD4 funzionali diventa una questione importante, poiché il sistema immunitario è costantemente attivato per reagire contro l’agente patogeno che colpisce la persona infetta.
Lo studio condotto dalla professoressa Stäger nel suo laboratorio presso il Centro di ricerca sulle biotecnologie Armand-Frappier Santé dell’INRS suggerisce che queste cellule potrebbero avere più di un asso nella manica per mantenere la loro vitalità.
“Abbiamo scoperto una nuova popolazione di cellule CD4 nei topi infettati dal parassita responsabile della leishmaniosi viscerale. Queste cellule T hanno proprietà interessanti”, ha affermato il professor Stäger.
Osservando queste nuove cellule, gli scienziati hanno notato che aumentano di numero durante la fase cronica della malattia e che, come le cellule progenitrici , sono capaci di autorinnovarsi o differenziarsi in altre cellule effettrici responsabili dell’eliminazione del parassita, o cellule regolatrici. cellule che inibiscono la risposta dell’ospite.
Il professor Stäger sottolinea che le cellule T CD4 normalmente si differenziano in cellule effettrici dalle cellule T CD4 “ingenue”. Ma durante le infezioni croniche, a causa della costante necessità di generare cellule effettrici, le cellule T CD4 naive sono altamente sollecitate e possono esaurirsi.
Crediamo che nella fase cronica della leishmaniosi viscerale, la nuova popolazione che abbiamo identificato sia responsabile della generazione di cellule effettrici e regolatrici. Ciò consentirebbe all’ospite di prevenire l’esaurimento del suo pool esistente di cellule T CD4 naive per un determinato antigene”, spiega Dottorato di ricerca studentessa e prima autrice dello studio, Sharada Swaminathan.
La nuova popolazione di linfociti scoperta dal team dell’INRS potrebbe rappresentare un decisivo potenziatore immunitario, prendendo il posto delle cellule T CD4 naive eccessivamente sollecitate.
“Se riuscissimo a capire come indirizzare questa nuova popolazione di linfociti a differenziarsi in una cellula effettrice protettiva, potremmo aiutare l’ospite a liberarsi del parassita Leishmania”, ha affermato il professor Stäger.

Lo studio menziona anche che cellule simili a questa nuova popolazione di linfociti T CD4 sono state osservate nei topi infettati dal virus della coriomeningite linfocitaria e nei topi portatori del verme intestinale H. polygyrus. Quindi è del tutto possibile che questa popolazione sia presente in altre infezioni croniche o in altri ambienti infiammatori cronici.
Questa sovrapposizione pone le basi per una portata ancora più ampia per la scoperta fatta dal team del professor Stäger. “Se la nostra ipotesi fosse corretta, queste cellule potrebbero essere sfruttate a livello terapeutico non solo per la leishmaniosi viscerale, ma anche per altre infezioni croniche”, conclude il ricercatore.
Questo articolo è stato scritto in collaborazione con Sharada Swaminathan, Linh Thuy Mai, Alexandre P. Meli, Liseth Carmona-Pérez, Tania Charpentier, Alain Lamarre, Irah L. King e Stäger.
Informazioni su uno dei principali attori nella leishmaniosi viscerale cronica
In un articolo apparso su PLOS Pathogens, la professoressa dell’INRS Simona Stäger e il suo team mostrano come il parassita Leishmania donovani sfrutta una risposta fisiologica a bassi livelli di ossigeno (ipossia) per instaurare un’infezione cronica.
Il parassita della leishmaniosi viscerale provoca un’infiammazione cronica che ingrossa la milza e crea un microambiente ipossico. Per compensare la mancanza di ossigeno e garantire la propria sopravvivenza, le cellule si adattano inducendo l’espressione del fattore di trascrizione HIF-1α, il principale regolatore della risposta cellulare all’ipossia.
La professoressa Stäger e il suo team hanno dimostrato l’effetto di questo regolatore chiave sulla funzione dei monociti e dei macrofagi durante la leishmaniosi vicerale, la forma più grave di una malattia tropicale che colpisce milioni di persone in tutto il mondo. Queste cellule sono i principali bersagli del parassita L. donovani
“Il nostro lavoro di laboratorio dimostra che l’HIF-1α svolge un ruolo chiave nell’instaurarsi di infezioni croniche da Leishmania, riducendo la capacità dei monociti e dei macrofagi di uccidere il parassita. Abbiamo anche scoperto che l’HIF-1α conferisce a queste cellule proprietà immunosoppressive”, spiega il professor Stäger.
La lotta contro il parassita della Leishmaniosi
Il team del professor Albert Descoteaux del Centre INRS – Institut Armand-Frappier, Canada, ha acquisito una migliore comprensione di come il parassita Leishmania donovani riesca a superare in astuzia il sistema immunitario umano e proliferare impunemente, causando la leishmaniosi viscerale, un’infezione cronica potenzialmente fatale se non trattata. Questa scoperta scientifica è stata recentemente pubblicata su PLoS Pathogens.
Circa 350 milioni di persone vivono in aree in cui è possibile contrarre la leishmaniosi. Oltre il 90% dei casi sono segnalati in India, Bangladesh, Nepal, Sudan e Brasile. La leishmaniosi si trova anche in Messico e in altre parti del Sud America. Non esistono vaccini efficaci per prevenire la leishmaniosi e i problemi di resistenza riducono notevolmente l’efficacia dei farmaci convenzionali.
Il parassita, che viene trasmesso agli esseri umani durante il pasto di sangue dei flebotomi infetti, viene internalizzato tramite i macrofagi nel fegato, nella milza e nel midollo osseo. Tuttavia, questo parassita riesce ad alterare il normale processo di fagocitosi (distruzione di corpi estranei), resistere a questo processo, replicarsi e infettare altri macrofagi.
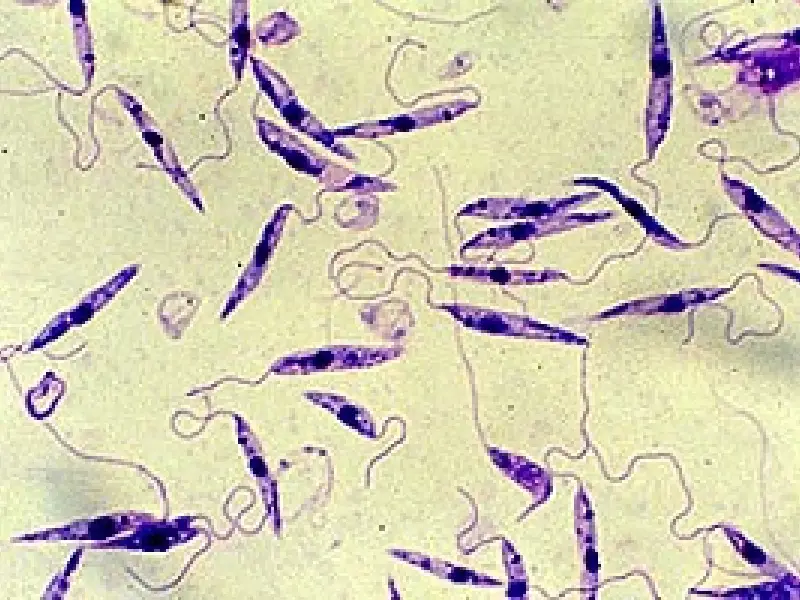
Questo processo di resistenza comporta in particolare il blocco del normale processo di acidificazione all’interno del macrofago interrompendo le fusioni delle membrane.
Ad oggi, pochi studi hanno tentato di identificare i regolatori di queste fusioni di membrana e il loro ruolo nel processo di biogenesi fagolisosomiale (un compartimento in cui i microrganismi patogeni vengono solitamente uccisi).
Il lavoro del dottorando Adrien Vinet e del professor Descoteaux ha gettato nuova luce sulla biologia dei parassiti della Leishmania , in particolare sui meccanismi molecolari attraverso i quali riescono a superare in astuzia il sistema immunitario umano.
I parassiti della leishmaniosi sfuggono alla morte sfruttando la risposta immunitaria alle punture dei flebotomi
La leishmaniosi cutanea, una malattia caratterizzata da ulcere cutanee dolorose, si verifica quando il parassita Leishmania major , o una specie affine, viene trasmesso a un ospite mammifero attraverso la puntura di un flebotomo infetto. In un nuovo studio del National Institute of Allergy and Infectious Diseases (NIAID), parte del National Institutes of Health, gli scienziati hanno scoperto che L. major fa i suoi danni non solo schivando ma anche sfruttando la risposta di guarigione delle ferite alla sabbia morsi di mosca.
“Questo lavoro cambia il quadro da manuale del ciclo di vita del parassita della leishmaniosi, identificando la cellula infiammatoria nota come neutrofilo come la cellula predominante coinvolta durante l’inizio dell’infezione”, afferma il direttore del NIAID Anthony S. Fauci, MD
Utilizzando tecniche microscopiche avanzate, che hanno consentito l’imaging in tempo reale della pelle di topi vivi infettati da L. major, i collaboratori del NIAID Nathan C. Peters, Ph.D., e Jackson Egen, Ph.D., hanno scoperto che i neutrofili, bianchi le cellule del sangue che ingeriscono e distruggono i batteri svolgono un ruolo sorprendente nello sviluppo della malattia.
I neutrofili venivano rapidamente reclutati dal sangue circolante e nella pelle dei topi infetti, dove sciamavano attorno ai punti dei morsi dei flebotomi e inghiottivano efficacemente i parassiti.
A differenza di molti altri organismi infettivi che muoiono all’interno dei neutrofili, i parassiti L. major sembrano essersi evoluti in modo da sfuggire alla morte, sopravvivendo effettivamente per lunghi periodi di tempo all’interno dei neutrofili.
Alla fine i parassiti fuggono dai neutrofili ed entrano nei macrofagi, un’altra popolazione di cellule immunitarie della pelle, dove possono stabilire un’infezione a lungo termine.
“I parassiti trasmessi dai flebotomi ai topi privi di neutrofili hanno più difficoltà a stabilire un’infezione e a sopravvivere. Ciò dimostra l’importanza dei neutrofili nel sito di una puntura di flebotomi infetto e suggerisce il percorso inaspettato intrapreso dal parassita dal flebotomi ai neutrofili fino ai macrofagi. è una componente critica di questa malattia”, afferma il dottor Peters.
Inoltre, afferma il dottor Egen, lo studio rivela come i neutrofili lasciano i vasi sanguigni localmente infiammati e si spostano nei tessuti; fornisce nuove informazioni sul movimento di queste cellule immunitarie all’interno degli ambienti tissutali danneggiati e al contatto con agenti patogeni; e fornisce immagini video che rivelano l’ingresso attivo dei neutrofili nelle aree della pelle danneggiata.