Approvato dalla FDA all’inizio di quest’anno, il lecanemab come terapia per l’Alzheimer è un anticorpo che riduce l’accumulo nel cervello di un peptide appiccicoso chiamato beta-amiloide (Aβ), che si ritiene sia il principale responsabile della malattia. Distribuito in infusioni bimestrali,lecanemab prende di mira specificamente le protofibrille, il tipo di grumi di Aβ ritenuti i più neurotossici. Gli studi hanno dimostrato che lecanemab rallenta il declino cognitivo e funzionale nei pazienti con Alzheimer in stadio iniziale.
Un nuovo studio sul farmaco è stato pubblicato su Proceedings of the National Academy of Sciences.
Lecanemab: ecco cosa dicono le ultime ricerche
Come per molte altre terapie all’avanguardia, sappiamo di più sull’efficacia di lecanemab che su come funziona effettivamente. Un nuovo studio identifica un possibile mezzo per il suo impatto sui pazienti.

“Crediamo di aver trovato un meccanismo che è uno dei motivi per cui il lecanemab funziona”, afferma la co-autrice senior Erin Norris, professoressa associata di ricerca presso il Laboratorio di Neurobiologia e Genetica Patricia e John Rosenwald del Rockefeller.
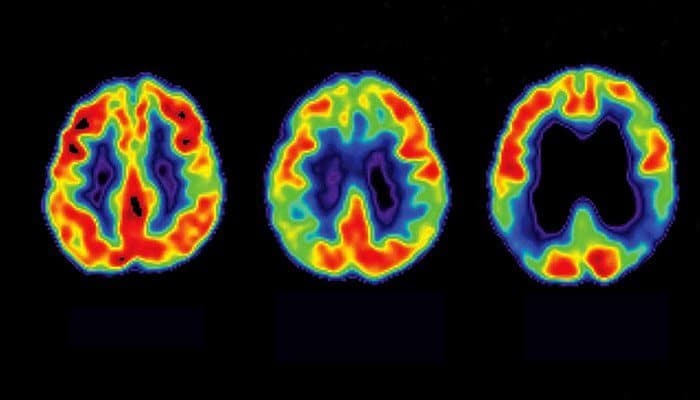
L’Alzheimer è la causa più comune di demenza nel mondo. Negli Stati Uniti, sei milioni di persone convivono con la malattia; 1 donna su 5 e 1 uomo su 10 sopra i 45 anni sono a rischio di svilupparla. Dall’inizio del secolo, le morti per Alzheimer sono aumentate del 145%, rappresentando 1 decesso su 3 degli anziani.
La malattia è spaventosamente complessa. La maggior parte dei casi di Alzheimer non hanno una semplice causa genetica, ma sono dovuti al mix unico di genetica, stile di vita, esposizione ambientale e fattori di rischio di ogni persona , che i ricercatori devono ancora distinguere.
I lenti progressi sulle terapie farmacologiche sono stati altrettanto sconcertanti. Fino al lecanemab, il candidato più promettente era l’aducanumab, una terapia con anticorpi che riduce anche i cluster di Aβ nel cervello. Il farmaco ha ottenuto l’approvazione della FDA nel 2021, ma aducanumab provoca effetti collaterali devastanti in alcuni pazienti. Le peggiori sono le anomalie dell’imaging correlate all’amiloide, o ARIA, che assumono due forme: edema, accumulo di acqua nei tessuti o emorragia.
Aducanumab causa ARIA in circa il 35% dei pazienti. Altre due terapie anti-Aβ ancora in sperimentazione clinica non hanno avuto risultati migliori: gantenerumab causa ARIA nel 30% dei pazienti e donanemab nel 27%.
Il lecanemab, tuttavia, provoca ARIA solo nel 10% dei pazienti. Incuriosito da questo numero basso, il team Rockefeller aveva due domande: perché è efficace e perché causa molta meno ARIA?
I ricercatori sapevano dove volevano guardare: il tipo specifico di grumi di Aβ target del lecanemab, noti come protofibrille. Sapevano già che l’Aβ è responsabile dell’attivazione del sistema di contatto del plasma – una sorta di backup del sistema primario di coagulazione del corpo, che impedisce al sangue di fuoriuscire nel sito di una ferita – e sospettavano che le protofibrille di Aβ avessero una relazione unica con l’Aβ. sistema di contatto.
Il laboratorio aveva precedentemente documentato che il sistema di contatto era più attivato nei pazienti con Alzheimer che nelle persone senza demenza e aveva identificato connessioni tra il declino cognitivo caratteristico dell’Alzheimer e le anomalie cerebrovascolari associate come emorragia, diminuzione del flusso sanguigno cerebrale e malattia dei piccoli vasi.
Il fatto che lecanemab abbia come bersaglio le protofibrille Aβ e sia efficace contro l’Alzheimer ha dato loro un’opportunità di scelta. Utilizzando circa una dozzina di test, studi e analisi diversi, il team ha studiato il plasma di donatori sani per analizzarne i dettagli meccanicistici.
I ricercatori hanno scoperto che delle molteplici forme di Aβ, le protofibrille erano l’unica forma che attivava il sistema di contatto. È una specie di riccioli d’oro dell’Aβ: le forme più piccole erano troppo piccole per l’attivazione del sistema di contatto e la forma più grande era troppo grande, ma la protofibrilla era perfetta.
Le protofibrille hanno la giusta quantità di spazio affinché due proteine plasmatiche, il fattore XII della coagulazione e il chininogeno ad alto peso molecolare (HK), si leghino l’una vicino all’altra sulle loro superfici.
Quando ciò accade, l’HK viene scisso, producendo un peptide chiamato bradichinina che dilata i vasi sanguigni. La bradichinina ha diversi scopi nel corpo e può essere particolarmente utile per abbassare la pressione sanguigna. Ma la sovrapproduzione di bradichinina porta a infiammazione ed edema, l’effetto collaterale dell’ARIA che ha rappresentato la rovina delle altre terapie anti-Aβ.
Il lecanemab, secondo loro, interferisce con l’Aβ in due modi: riduce la quantità di accumulo nel cervello e impedisce alle protofibrille di attivare il sistema di contatto, che a sua volta inibisce la produzione di bradichinina. Ciò potrebbe spiegare perché lecanemab provoca meno ARIA.
“È piuttosto sorprendente”, afferma Norris, “che la forma di Aβ che attiva specificamente il sistema di contatto sia la stessa forma di Aβ presa di mira dal lecanemab”.
Il team Rockefeller è particolarmente incuriosito da questa scoperta perché è parallela al loro lavoro su un anticorpo da loro sviluppato chiamato 3E8. Come il lecanemab, 3E8 blocca l’attivazione del sistema di contatto, ma lo fa prendendo di mira HK, impedendone la scissione e la produzione di bradichinina.
“Se blocchi il sistema di contatto, avrai meno patologie di Alzheimer”, afferma il co-autore senior Sidney Strickland, Zachary del Rockefeller ed Elizabeth M. Fisher, professore di Alzheimer e malattie neurodegenerative.
Questa terapia anti-HK potrebbe essere utilizzata per trattare i pazienti con Alzheimer da sola o in combinazione con i farmaci anti-Aβ esistenti, dice Norris. “Potresti usarlo come complemento a lecanemab o donanemab. Con questi farmaci, blocchi l’Aβ, ma ottieni comunque un’attivazione del sistema di contatto causata da altri fattori, che portano ad ARIA. Se blocchi completamente il sistema di contatto, potresti basta eliminare ARIA.”
Sulla base degli studi sui primati, Strickland prevede che il 3E8 venga somministrato una volta al mese, potenzialmente contemporaneamente a una delle terapie bimestrali anti-Aβ. “Quindi potresti somministrarlo da solo, trasportarlo su lecanemab o eventualmente persino creare una miscela”, afferma Strickland.
Inoltre, aggiunge Norris, se 3E8 si dimostrasse efficace nei test clinici – che sono ancora molto avanti – potrebbe essere potenzialmente usato per trattare una varietà di malattie con una cosa in comune: l’attivazione del sistema di contatto. “La disregolazione del sistema di contatto è coinvolta nel COVID, nell’anemia falciforme , nell’angioedema ereditario, nella malattia infiammatoria intestinale, nella sepsi, nel lupus, nell’artrite e persino nelle metastasi del cancro”.
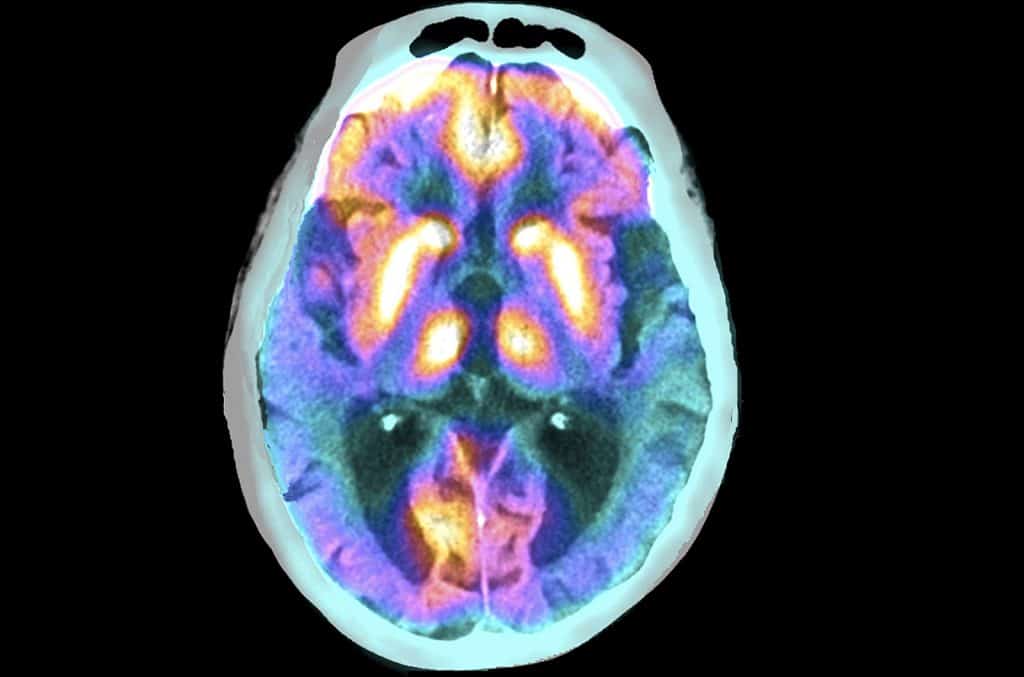
Per la prima volta, i ricercatori hanno descritto la struttura di un tipo speciale di proteina della placca beta-amiloide associata alla progressione della malattia di Alzheimer (AD). In un rapporto pubblicato il 10 maggio sulla rivista Neuron , gli scienziati hanno dimostrato che i piccoli aggregati della proteina beta-amiloide potrebbero fluttuare attraverso il fluido del tessuto cerebrale, raggiungendo molte regioni del cervello e interrompendo il funzionamento dei neuroni locali.
La ricerca ha inoltre fornito prove del fatto che un trattamento per l’AD recentemente approvato potrebbe neutralizzare questi piccoli aggregati diffusibili.
Come causa di demenza, l’AD colpisce più di 50 milioni di persone in tutto il mondo. Precedenti ricerche avevano scoperto che i pazienti con AD hanno un accumulo anomalo di una sostanza naturale, la proteina beta amiloide, nel cervello che può interrompere la neurotrasmissione. Attualmente non esiste una cura per la malattia. Ma negli ultimi anni, gli scienziati hanno sviluppato nuovi trattamenti che possono ridurre i sintomi dell’AD come la perdita di memoria.
“Lo studio è tempestivo perché, per la prima volta nella storia umana, abbiamo un agente che può effettivamente curare le persone con Alzheimer in un modo che potrebbe rallentare il loro declino cognitivo”, afferma Dennis Selkoe, autore corrispondente dello studio presso il Brigham and Women’s Ospedale di Boston. “E non siamo mai stati in grado di dire quelle parole fino agli ultimi mesi.”
A gennaio, la Food and Drug Administration statunitense ha approvato il lecanemab, una terapia anticorpale per il trattamento dell’AD. In uno studio clinico di fase III, lecanemab ha rallentato il declino cognitivo nei pazienti con AD precoce. Gli scienziati sospettano che l’effetto positivo del farmaco possa essere associato alla sua capacità di legare e neutralizzare gli aggregati solubili della proteina beta amiloide, noti anche come protofibrille o oligomeri, che sono minuscoli grumi fluttuanti della proteina beta amiloide.
Questi piccoli grumi possono formarsi nel cervello prima di aggregarsi ulteriormente in grandi placche amiloidi. I piccoli aggregati possono anche staccarsi e diffondersi lontano dalle placche amiloidi già presenti.
“Ma nessuno è stato in grado di definire con rigore strutturale cos’è una ‘protofibrilla’ o un ‘oligomero’ a cui si lega il lecanemab”, afferma il primo autore Andrew Stern, neurologo del Brigham and Women’s Hospital. “Il nostro lavoro identifica quella struttura dopo averla isolata dal cervello umano . Questo è importante perché i pazienti e gli sviluppatori di farmaci vorranno sapere a cosa si lega esattamente il lecanemab. Potrebbe rivelare qualcosa di speciale su come funziona?”
Stern, Selkoe e il loro team hanno isolato con successo gli aggregati di beta-amiloide fluttuanti immergendo i tessuti cerebrali post-mortem di tipici pazienti con AD in soluzioni saline, che sono state poi centrifugate ad alta velocità. Questi minuscoli aggregati di proteina beta-amiloide accedono a importanti strutture cerebrali come l’ippocampo, che svolge un ruolo importante nella memoria. Lavorando con i colleghi del Laboratorio di Biologia Molecolare di Cambridge, nel Regno Unito, hanno determinato la struttura atomica di questi minuscoli aggregati, fino al singolo atomo.
“Se non conosci i tuoi nemici, è difficile sconfiggerli”, dice Selkoe. “È stata una bella coincidenza che tutto il lavoro che stavamo svolgendo sia avvenuto proprio nel momento in cui il lecanemab è diventato ampiamente conosciuto e disponibile. Questa ricerca riunisce l’identità del cattivo e qualcosa che può neutralizzarlo.”
Successivamente, il team intende osservare come questi minuscoli aggregati di beta-amiloide viaggiano attraverso il cervello degli animali viventi e studiare come il sistema immunitario risponde a queste sostanze tossiche. Ricerche recenti hanno dimostrato che la reazione del sistema immunitario del cervello all’amiloide- beta è una componente chiave dell’AD.
“Se riusciamo a capire esattamente come queste piccole fibrille diffusibili esercitano tossicità, allora forse i prossimi farmaci per l’AD potrebbero essere migliori”, dice Stern.