Un farmaco sperimentale per il trattamento del morbo di Alzheimer, il lecanemab, è stato accolto da alcuni esperti come il trattamento che tutti stavamo aspettando. Ma quanta speranza dovremmo riporre in lecanemab? innanzitutto bisogna spiegare come funziona esattamente questa terapia farmacologica, gli effetti collaterali e qual è la prospettiva più realistica su questo farmaco.
Lecanemab: qualche dettaglio sul suo effetto terapeutico
Più di55 milioni di persone in tutto il mondo hanno la demenza , un gruppo di malattie che influenzano il modo in cui funziona il cervello di una persona. Tra il 60% e l’80% di tutti i casi di demenza interessano il morbo di Alzheimer.
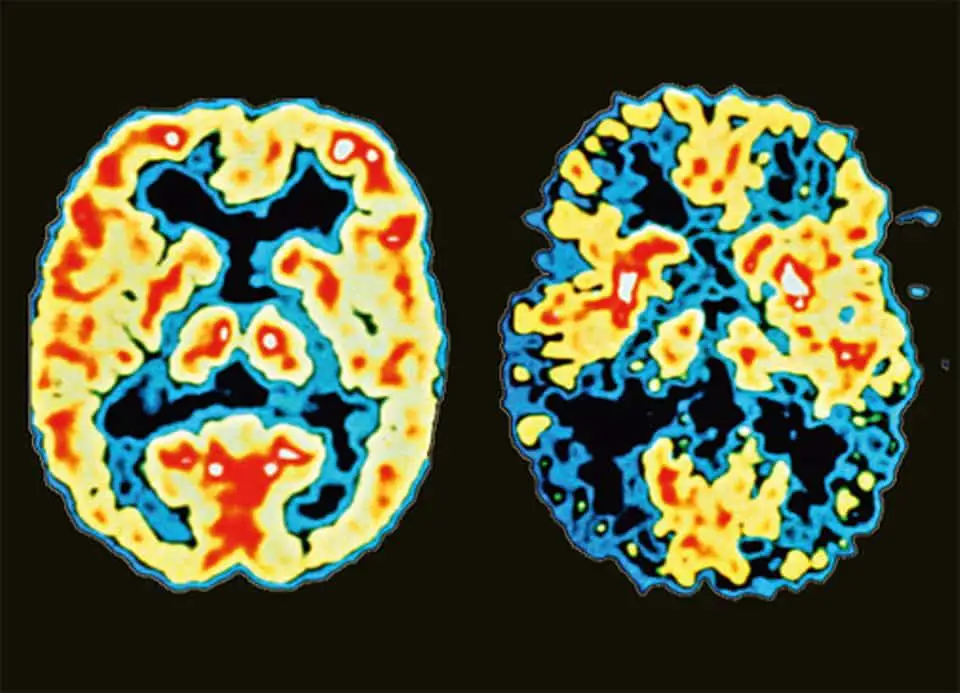
I ricercatori prevedono inoltre che il numero di persone che convivono con la demenza aumenterà fino a quasi153 milioni entro il 2050. Attualmente non esiste una cura per il morbo di Alzheimer. Tuttavia, ci sono alcuni farmaci approvati dalla Food and Drug Administration (FDA) per il trattamento dell’Alzheimer volti a rallentare la progressione della malattia o ad aiutare a ridurre alcuni sintomi della condizione, con più potenziali trattamenti – come il lecanemab – attualmente in ricerca e sviluppo.
Lecanemab è un farmaco sperimentale per il trattamento del morbo di Alzheimer sviluppato congiuntamente dalle società farmaceutiche Eisai e Biogen.
Lecanemab è un tipo di farmaco chiamato aanticorpo monoclonale. Il corpo umano produce naturalmente anticorpi per difendersi dalle infezioni . Gli scienziati hanno sviluppato un anticorpo monoclonale in un ambiente di laboratorio per attaccare uno specifico materiale estraneo nel corpo, noto come anantigene.
Quando viene introdotto nel corpo di una persona, l’anticorpo monoclonale stimola il sistema immunitario a distruggere l’antigene mirato. I medici hanno recentemente utilizzato anticorpi monoclonali per trattare COVID-19 e alcuni tumori.
Il Dottor Christopher H. Van Dyck, professore di psichiatria, neurologia e neuroscienze, direttore dell’Unità di ricerca sul morbo di Alzheimer, direttore del Centro di ricerca sul morbo di Alzheimer di Yale e direttore della Divisione di psichiatria dell’invecchiamento e geriatrica e della Yale School of Medicine, è anche l’autore principale di uno studio recentemente pubblicato sul New England Journal of Medicine che riporta lo studio clinico di conferma di fase 3 Clarity AD di Eisai su lecanemab.
“La speranza è che interferisca con la patogenesi della malattia di Alzheimer e rallenti la progressione clinica della malattia”, ha dichiarato Van Dyck.
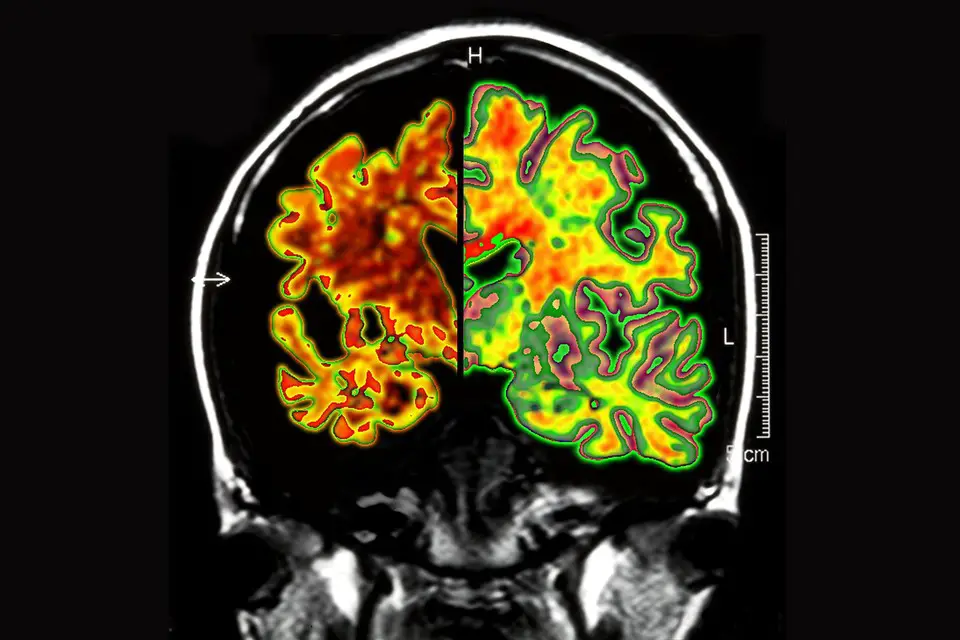
Secondo il dottor Emer MacSweeney , CEO e direttore medico di Re:Cognition Health, e ricercatore principale per lo studio clinico di conferma di fase 3 Clarity AD sul lecanemab, la proteina beta-amiloide che si accumula nel cervello nelle persone con malattia di Alzheimer è in definitiva tossica a certe cellule cerebrali, la maggior parte degli esperti sembra essere d’accordo.
“La graduale distruzione di queste cellule cerebrali porta allo sviluppo dei sintomi cognitivi e di altro tipo, che tipicamente si sviluppano e progrediscono, inesorabilmente, negli individui con malattia di Alzheimer, portando a una grave demenza”, ha spiegato l’esperto.
La dottoressa Karen D. Sullivan , neuropsicologa certificata dal consiglio di amministrazione e proprietaria di I CARE FOR YOUR BRAIN a Pinehurst, nella Carolina del Nord, ha affermato che la cosa entusiasmante di questa classe di farmaci è che sono i primi farmaci modificanti la malattia che abbiamo mai avuto per Il morbo di Alzheimer.
“Ciò significa che questi farmaci rimuovono effettivamente i depositi di amiloide-beta dal cervello. “Tutto ciò che abbiamo avuto fino ad oggi è stato in grado di offrire solo una lieve riduzione dei sintomi e non ha fatto nulla per influire sulla gravità o sul decorso della malattia”, ha specificato Sullivan.
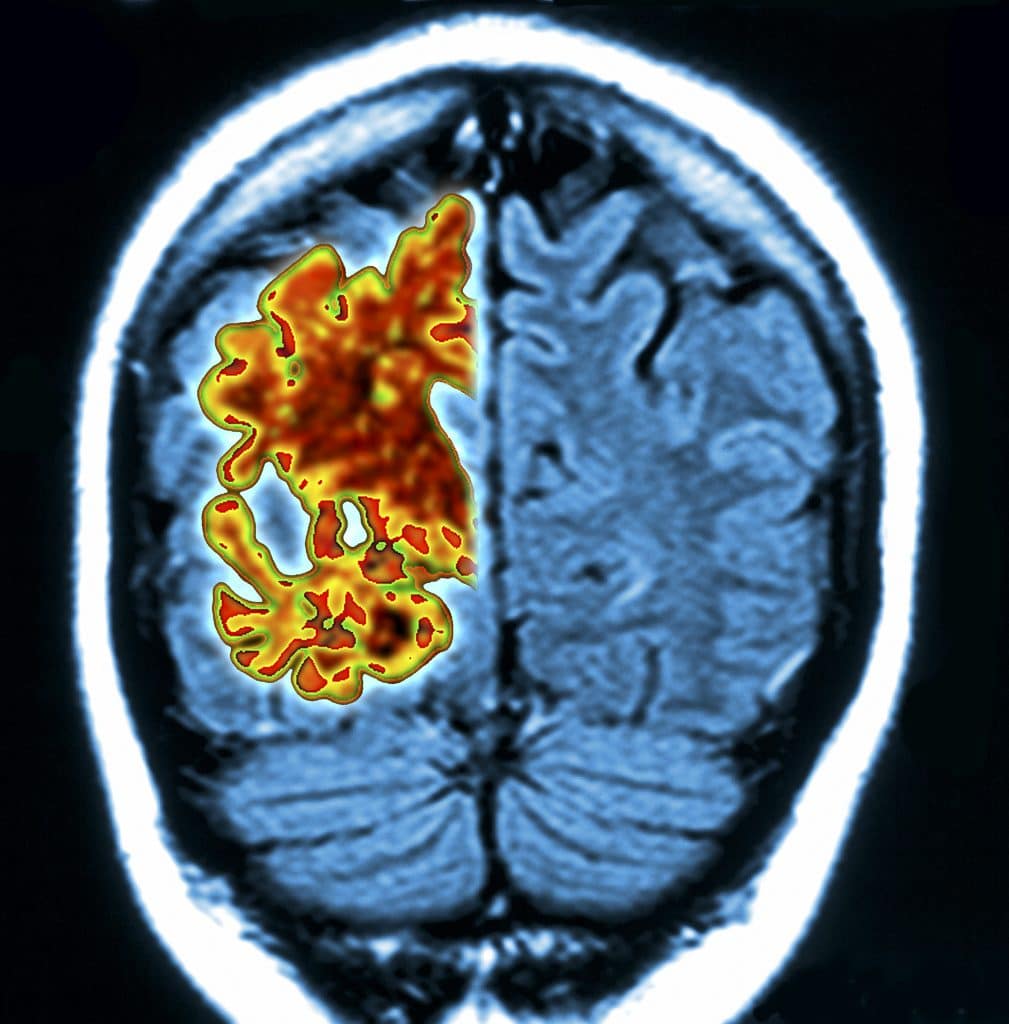
“Ci sono stati alcuni altri farmaci all’interno della categoria degli anticorpi monoclonali che hanno ottenuto l’approvazione provvisoria della FDA, ma alla fine hanno avuto risultati deludenti”, ha continuato.
“In un confronto diretto con gli anticorpi anti-amiloide aducanumab egantenerumab, si dice che il lecanemab rimuova in modo più efficace le placche amiloidi perché interviene prima nel processo patologico che contribuisce alla malattia di Alzheimer e con minori effetti collaterali. La speranza è che eliminando la placca amiloide dal cervello possiamo ripristinare un certo grado di funzionalità e prevenire, o almeno rallentare significativamente, il declino”, ha aggiunto Sullivan.
Alla fine di novembre 2022, Eisai ha presentato i risultati completi della sua sperimentazione clinica di fase 3 Clarity AD per lecanemab alla 15a conferenza Clinical Trials on Alzheimer’s Disease (CTAD).
Durante la sperimentazione clinica, circa 1.800 adulti di età compresa tra 50 e 90 anni con malattia di Alzheimer in fase iniziale hanno ricevuto lecanemab o un placebo. I partecipanti hanno anche ricevuto valutazioni di alcune abilità cognitive e funzionali sia prima dell’inizio del processo, sia 18 mesi dopo.
Infine, i partecipanti hanno eseguito scansioni PET per verificare la presenza di amiloide nel cervello. Al follow-up di 18 mesi, i ricercatori hanno riferito che le persone che hanno assunto lecanemab hanno rallentato il loro declino cognitivo del 27% rispetto a coloro che hanno assunto il placebo.
“I risultati dello studio clinico Clarity hanno anche dimostrato che il lecanemab ha effetti benefici sui biomarcatori dell’amiloide,tau e altre misure fisiopatologiche”, ha affermato il dott. MacSweeney. “Quindi il lecanemab non solo ha rimosso direttamente le placche amiloidi, ma ha anche avuto effetti a valle sulla patologia tau“.
Dopo aver ascoltato i dati presentati alla conferenza CTAD, il dottor Ronald Petersen , neurologo e direttore del Centro di ricerca sulla malattia di Alzheimer della Mayo Clinic e del Mayo Clinic Study of Aging, ha detto a MNT che i dati erano “piuttosto impressionanti”.
“Il farmaco ha fatto quello che doveva fare: ha coinvolto il bersaglio appropriato nel cervello, vale a dire l’amiloide, e ne ha rimosso un mucchio in modo tale che la maggior parte delle persone è scesa al livello di soglia effettivo per l’amiloide, il che significa che l’hanno rimossa alla soglia negativa per avere l’amiloide nel cervello”, ha spiegato.
“E poi c’è stata anche una risposta clinica corrispondente a questo”, ha aggiunto il dott. Petersen. “È stata una risposta clinica modesta: non ha fermato la malattia, non ha migliorato nessuno, non che avrebbe dovuto. E ha fatto quello che doveva. E penso che il livello di stabilizzazione nelle persone trattate con il farmaco sia clinicamente significativo”.
Alla conclusione dello studio, i ricercatori hanno anche segnalato alcuni potenziali effetti collaterali derivanti dall’uso di lecanemab.
Secondo il dottor MacSweeney, il lecanemab è stato generalmente ben tollerato e gli effetti collaterali più comuni sono stati:
una reazione correlata all’infusione, poiché il farmaco viene erogato dainfusione endovenosa ogni 2 settimane
Anomalia di imaging correlata all’amiloide (ARIA)-E, ARIA-H
mal di testa .
L’ARIA, ha spiegato, è un effetto collaterale che comporta un’emorragia o un accumulo di liquido nel cervello: “Il profilo di incidenza dell’ARIA rientrava nelle aspettative nello studio Clarity e l’ARIA sintomatica era bassa”, ha affermato il dott. MacSweeney.
“Quindi, per coloro che hanno sviluppato prove di ARIA, questo era per lo più asintomatico, il che significa che il paziente non era a conoscenza di aver sviluppato la condizione; è stato rilevato solo dalla risonanza magnetica e nella maggior parte dei casi il trattamento è continuato e non ha portato lo studio a non giungere alla sua conclusione e non influenzerà la richiesta alla [FDA] e agli organismi di regolamentazione in altri paesi per una licenza per lecanemab da rendere disponibile nel mercato”, ha osservato.
La dottoressa Verna Porter , neurologa e direttrice del Dementia, Alzheimer’s Disease and Neurocognitive Disorders presso il Providence Saint John’s Health Center di Santa Monica, in California, ha affermato che sebbene l’ARIA a volte possa essere letale, è curabile se il farmaco che causa l’interruzione o la riduzione della dose.
“Nel processo di approvazione, la FDA dovrà considerare i dati dello studio che dimostrano che le persone che assumono farmaci anticoagulanti possono avere un rischio leggermente più elevato di eventi emorragici, prima di determinare se il lecanemab richiede un’ulteriore etichetta di avvertenza sul potenziale rischio di emorragia”, ha specificato: “La FDA dovrà anche rivedere e confrontare il rischio di ARIA-E tra le persone che assumono lecanemab con il rischio associato ad altri farmaci che riducono l’amiloide”.
Sapendo cosa abbiamo fatto finora su lecanemab, quali dovrebbero essere le nostre aspettative più realistiche sulla sua sicurezza ed efficacia? La dottoressa Heather Snyder , vicepresidente per le relazioni mediche e scientifiche dell’Associazione Alzheimer. La studiosa ha osservato che questi sono i risultati più incoraggianti negli studi clinici sul trattamento dell’Alzheimer fino ad oggi.
“Questi risultati indicano che il lecanemab può dare alle persone più tempo o vicino alle loro piene capacità per partecipare alla vita quotidiana, rimanere indipendenti e prendere future decisioni sanitarie”, ha affermato.
“Trattamenti che offrono questi benefici a quelli conlieve deterioramento cognitivo(MCI) dovute al morbo di Alzheimer e alla demenza di Alzheimer precoce sono altrettanto preziose dei trattamenti che prolungano la vita di coloro che sono affetti da altre malattie terminali”, ha aggiunto il dott. Snyder.
“Sono fiduciosa dal punto di vista della ricerca, questa è una svolta che quelli di noi che studiano l’Alzheimer stavano aspettando, ma sono meno fiducioso che questa sarà la ‘grande cosa’ che aiuterà la maggior parte dei miei attuali pazienti.
Negli studi clinici, i partecipanti che hanno assunto questo farmaco hanno visto una riduzione del 27% in 18 mesi del declino cognitivo previsto, il che sembra davvero significativo, ma l’impatto di questo nel mondo reale potrebbe non essere evidente per le famiglie e questo è ciò che conta davvero.
Ciò che è efficace statisticamente non è sempre efficace clinicamente. Il set di dati completo non è stato ancora realizzato, quindi rimango di mentalità aperta sul fatto che questo potrebbe essere un punto di svolta”, ha asserito Sullivan.
Lecanemab potrebbe essere sulla buona strada per diventare disponibile per i pazienti di età pari o superiore a 65 anni negli Stati Uniti già dal prossimo anno (2023), ma gli esperti avvertono che c’è ancora molta strada da fare per trovare il trattamento migliore e più efficace per il morbo di Alzheimer: “Penso che questo farmaco sia un passo monumentale nella giusta direzione, ma probabilmente mancano ancora 5-10 anni al tipo di potente intervento farmacologico che tutti stiamo aspettando”, ha aggiunto la Dottoressa Sullivan.
E mentre la dottoressa Porter ha definito i risultati della sperimentazione clinica “incoraggianti”, ha affermato che stanno ancora imparando di più sulla malattia di Alzheimer che potrebbe avere un impatto sui farmaci futuri.
“Stiamo imparando che la deposizione di placche amiloidi porta alla disorganizzazione di un’altra proteina, la tau, che crea ‘grovigliFonte attendibile’ che interrompono le connessioni critiche tra i neuroni”, ha spiegato. “Potenzialmente, la combinazione di un farmaco anti-amiloide (ad esempio, lecanemab) con un composto anti-tau può rivelarsi ancora più efficace nel frenare la neurodegenerazione associata all’Alzheimer”.
“Abbiamo ancora molto da imparare sulla fisiopatologia del morbo di Alzheimer e sugli eventi primari e scatenanti che portano al suo sviluppo, che potrebbero rivelarsi gli obiettivi più efficaci per i futuri interventi terapeutici”, ha sottolineato il dott. Porter.
Per quanto riguarda l’Italia, secondo l’EpiCentro ISS: “Le demenze comprendono un insieme di patologie (demenza di Alzheimer, demenza vascolare, frontotemporale, a corpi di Lewy, ecc.) che hanno un impatto notevole in termini socio-sanitari sia perché un sempre maggior numero di famiglie ne sono drammaticamente coinvolte, sia perché richiedono una qualificata rete integrata di servizi sanitari e socio-assistenziali.
Le demenze, inoltre, rappresentano una delle maggiori cause di disabilità nella popolazione generale. Il progressivo invecchiamento della popolazione generale, sia nei Paesi occidentali che in quelli in via di sviluppo, fa ritenere queste patologie un problema sempre più rilevante in termini di sanità pubblica.
In Europa si stima che la demenza di Alzheimer (DA) rappresenti il 54% di tutte le demenze con una prevalenza nella popolazione ultrasessantacinquenne del 4,4%. La prevalenza di questa patologia aumenta con l’età e risulta maggiore nelle donne, che presentano valori che vanno dallo 0,7% per la classe d’età 65-69 anni al 23,6% per le ultranovantenni, rispetto agli uomini i cui valori variano rispettivamente dallo 0,6% al 17,6%.
I tassi d’incidenza per DA, osservati in Europa, indicano un incremento nei maschi da 0,9 casi per 1.000 anni-persona nella fascia d’età compresa tra i 65 e i 69 anni a 20 casi in quella con età maggiore di 90 anni; nelle donne, invece, l’incremento varia da 2,2 nella classe d’età compresa tra i 65 e i 69 anni a 69,7 casi per 1.000 anni-persona in quella >90 anni.
In Italia, a partire dal 1987, sono stati condotti alcuni studi di popolazione per stimare la prevalenza e l’incidenza della DA (1-7). I quindici comuni coinvolti nell’insieme di queste indagini epidemiologiche sono localizzati per il 47% al Centro, il 33% al Nord e il 20% al Sud. Sulla base dei risultati di questi studi si è cercato di stimare la prevalenza e l’incidenza della DA nella popolazione italiana.
Lo studio di dimensioni maggiori è l’ILSA (Italian Longitudinal Study on Aging), che ha utilizzato un approccio in due fasi: nella prima le persone incluse sono state intervistate sulla presenza di eventuali segni e sintomi della malattia; successivamente, sono state visitate per una conferma diagnostica tutte le persone con un punteggio al Mini-Mental State Examination (MMSE) inferiore a 24 o con una precedente diagnosi di demenza riferita da un familiare.
Su 5.462 persone eleggibili per lo studio ILSA, per 3.645 (66,7%) è stato completato lo screening per la demenza. Un’importante differenza con gli altri studi è che la popolazione inclusa in ILSA ha un’età compresa tra i 65 e gli 84 anni con l’eliminazione delle fasce d’età con la maggiore prevalenza di DA.
Lo studio ILSA presenta, inoltre, un’elevata percentuale di persone per le quali non è stato diagnosticato il tipo di demenza. Infatti, mentre la prevalenza per tutte le demenze è abbastanza in linea con quella osservata in Europa (circa il 6%), quella per DA è circa la metà (2,5% vs 4,4%)”.