Uno studio rivoluzionario condotto dal Dr. Marcus Conrad e dal suo team all’Helmholtz di Monaco, ha rivelato la scoperta di un rivoluzionario farmaco antitumorale noto come icFSP1, che aumenta la vulnerabilità delle cellule tumorali alla ferroptosi; i risultati di questa ricerca sono stati pubblicati sulla prestigiosa rivista Nature.
La ferroptosi è un processo cellulare caratterizzato dalla degradazione ossidativa ferro-dipendente delle membrane cellulari, contrastata dalla proteina soppressore della ferroptosi-1 (FSP1), un fattore cruciale nella regolazione della ferroptosi. Nonostante il potenziale di FSP1 come bersaglio promettente per la terapia del cancro, lo sviluppo di efficaci inibitori FSP1 in vivo è stato impegnativo.
Per colmare questa lacuna, il team di ricerca ha esaminato meticolosamente circa 10.000 composti di piccole molecole e ha identificato icFSP1 come un farmaco altamente potente e praticabile con efficacia in vivo.
Significativamente, il team ha svelato il meccanismo d’azione alla base di icFSP1, che comporta l’induzione della separazione di fase di FSP1, un fenomeno fisico all’interno delle cellule simile alla separazione di olio e acqua e curiosamente, l’icFSP1 ha mostrato una forte inibizione della crescita tumorale in vivo e ha portato a distinti condensati di FSP1 all’interno del tessuto tumorale, presentando un nuovo concetto per combattere i tumori promuovendo la separazione di fase di FSP1 e facilitando la ferroptosi.
La resistenza alla chemioterapia e le metastasi sono le principali sfide cliniche nel trattamento del cancro ma sorprendentemente, durante processi come la dedifferenziazione o il ricablaggio metabolico, alcune cellule tumorali maligne acquisiscono una vulnerabilità intrinseca alla ferroptosi, pertanto il targeting per ferroptosi è emerso come una strategia promettente per la terapia del cancro.
Quali sono i risultati ottenuti nello studio su icFSP1?
Nel 2019, il team del dottor Marcus Conrad aveva precedentemente identificato il primo inibitore specifico di FSP1, iFSP1.
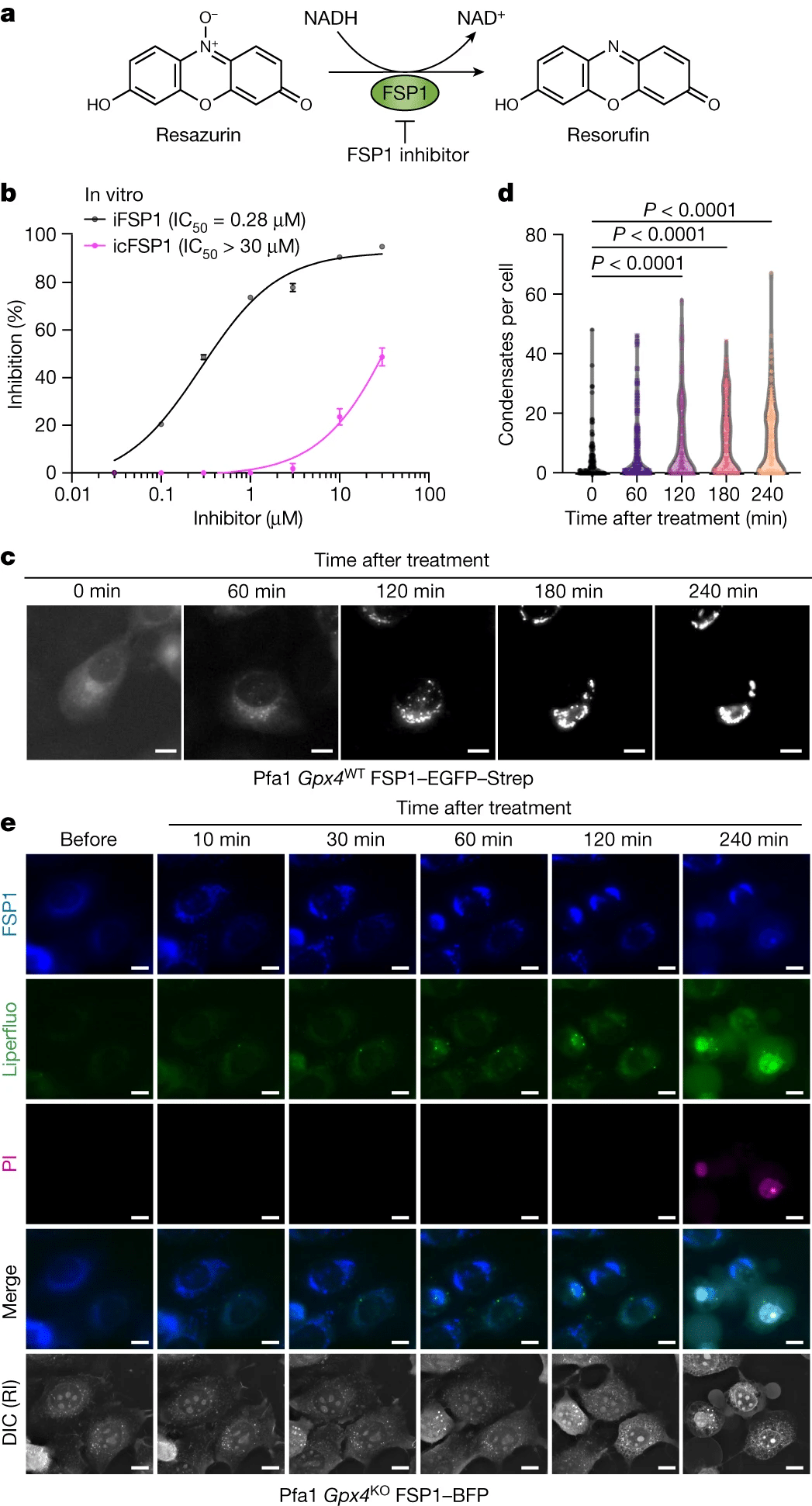
“Tuttavia, questo composto non è adatto per l’uso in vivo e mostra effetti fuori bersaglio ad alte concentrazioni”
ha spiegato Conrad. Per identificare gli induttori di ferroptosi attivi in vivo che mirano specificamente a FSP1, il team ha condotto una campagna di screening completa nelle cellule, seguita da rigorosi studi di convalida nel metabolismo e nella farmacocinetica dei farmaci (DMPK). Questi sforzi hanno portato alla scoperta di icFSP1, una nuova classe di composti che sensibilizzano numerose cellule tumorali umane alla ferroptosi e attenuano la crescita tumorale in vivo.
Attraverso indagini approfondite sul meccanismo d’azione di icFSP1, il team ha rivelato che icFSP1 non inibisce direttamente l’attività dell’enzima FSP1, ma piuttosto innesca la rilocalizzazione subcellulare di FSP1 attraverso la separazione di fase, distinguendola dal meccanismo d’azione dell’iniziale inibitore FSP1, iFSP1.
Toshitaka Nakamura, l’autore principale dello studio, ha ulteriormente chiarito che “le condensazioni FSP1 indotte da icFSP1 richiedono componenti strutturali distinti e miristoilazione N-terminale”, come dimostrato attraverso esperimenti che coinvolgono proteine FSP1 ricombinanti, varie linee cellulari e campioni tumorali.
La ferroptosi ha raccolto un immenso interesse in più campi, tra cui il cancro, le malattie neurodegenerative e le lesioni da ischemia/riperfusione, ed allo stesso modo, la separazione di fase è un fenomeno fisico fondamentale alla base della trasduzione del segnale e dei processi biologici di base associati a numerose malattie. Questo studio rappresenta la prima connessione in assoluto tra ferroptosi e separazione di fase.
“Il nostro studio servirà come modello prezioso per il futuro sviluppo di approcci terapeutici innovativi in malattie come il cancro, dove la ferroptosi/separazione di fase gioca un ruolo cruciale”
ha spiegato Conrad, offrendo una prospettiva promettente per i futuri progressi in questo campo.
Se sei attratto dalla scienza o dalla tecnologia, continua a seguirci, così da non perderti le ultime novità e news da tutto il mondo!