Un nuovo studio condotto da due scienziati dell’Università di Chicago ha rivelato come l’HIV si insinua nel nucleo mentre invade una cellula. Poiché i virus devono prendere il controllo della cellula di qualcun altro per replicarsi, sono diventati molto bravi in questo, inventando ogni sorta di trucchi.
Il lavoro è stato pubblicato sulla rivista Proceedings of the National Academy of Sciences.
HIV invade una cellula: ecco come
Secondo i loro modelli, il capside dell’HIV , che è a forma di cono, punta la sua estremità più piccola nei pori del nucleo e poi si aggancia. Una volta che il poro è sufficientemente aperto, il capside è abbastanza elastico da poter passare. È importante sottolineare che, hanno affermato gli scienziati, sia la flessibilità strutturale del capside che il poro stesso svolgono un ruolo nel processo di infiltrazione.
La scoperta, creata da una simulazione di migliaia di proteine che interagiscono, indicherà la strada verso una migliore comprensione dell’HIV e suggerirà nuovi bersagli per i farmaci terapeutici. “Ad esempio, si potrebbe provare a rendere il capside del virus meno elastico, cosa che i nostri dati suggeriscono ostacolerebbe la sua capacità di entrare nel nucleo”, ha detto Arpa Hudait, ricercatore presso l’Università di Chicago e primo autore dell’articolo.
Lo studio fornisce anche la simulazione più estesa mai realizzata finora del poro nucleare stesso, che è importante in molti processi biologici.
Hudait è membro del laboratorio di Gregory Voth, Distinguished Service Professor of Chemistry di Haig P. Papazian, specializzato in simulazioni per svelare i complessi processi biologici che si verificano quando i virus attaccano una cellula.
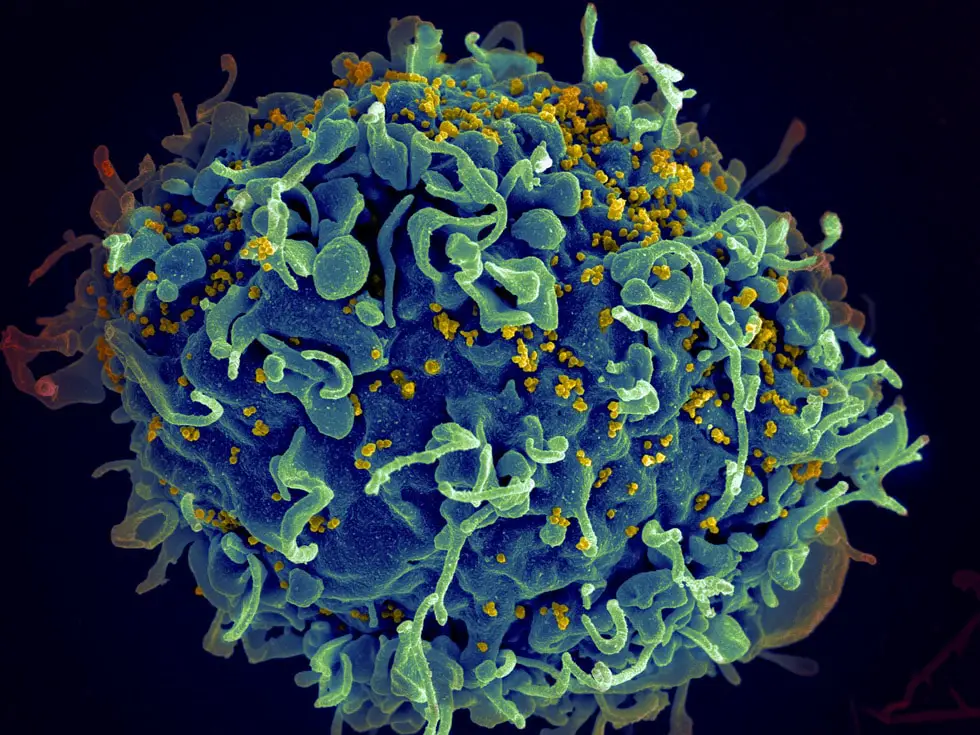
In questo caso, Voth e Hudait si sono concentrati su quello che è noto come capside dell’HIV, la capsula contenente il materiale genetico dell’HIV, che entra nel nucleo di una cellula ospite e costringe la cellula a creare copie dei componenti chiave dell’HIV.
Il capside è un macchinario complesso, costituito da più di mille proteine assemblate a forma di cono, con un’estremità più piccola e una più grande. Per entrare nel nucleo della cellula ospite, questa deve intrufolarsi. Ma gli scienziati non sapevano esattamente come ciò avvenga.
“Questa parte è stata un mistero per anni”, ha detto Voth, l’autore senior dello studio. “Per molto tempo nessuno era sicuro, ad esempio, se il capside si rompesse prima di entrare nel poro o dopo.”
Recenti studi di imaging avevano suggerito che il capside rimane intatto dimenandosi attraverso il complesso dei pori nucleari. Questa è essenzialmente la fessura di posta in cui il nucleo invia e riceve le consegne.
“Il complesso dei pori è un macchinario incredibile; non può far entrare proprio nulla nel nucleo della cellula, altrimenti saresti in guai seri, ma deve far entrare un bel po’ di roba. E in qualche modo, il Il capside dell’HIV ha capito come intrufolarsi”, ha detto Voth. “Il problema è che non possiamo guardarlo dal vivo. Bisogna compiere sforzi sperimentali eroici anche solo per ottenere una singola istantanea.”
Per colmare le lacune, Hudait ha costruito un’accurata simulazione al computer sia del capside dell’HIV che del complesso dei pori nucleari, che rappresentano migliaia di proteine che lavorano insieme.
Eseguendo le simulazioni, gli scienziati hanno visto che era molto più facile per il capside entrare nel poro incastrando prima la sua estremità più piccola e poi agganciandosi gradualmente. “Non ha bisogno di lavoro attivo per farlo, è solo fisica – quello che chiamiamo un cricchetto elettrostatico”, ha detto Voth. “È un po’ come se ti fosse mai stata stretta la cintura di sicurezza, e la cintura diventasse sempre più stretta.”
Hanno anche scoperto che sia il poro che il capside si deformano mentre procedono. È interessante notare che il reticolo di molecole che compongono la struttura del capside sviluppa piccole regioni di ordine inferiore per sopportare lo stress della pressione. “Non è come un solido che si comprime o si espande, come ci si potrebbe aspettare”, ha detto Hudait.
La scoperta potrebbe aiutare a spiegare perché i capsidi sono a forma di cono, piuttosto che di cilindro, che a prima vista potrebbe sembrare più facile da far passare attraverso un poro.
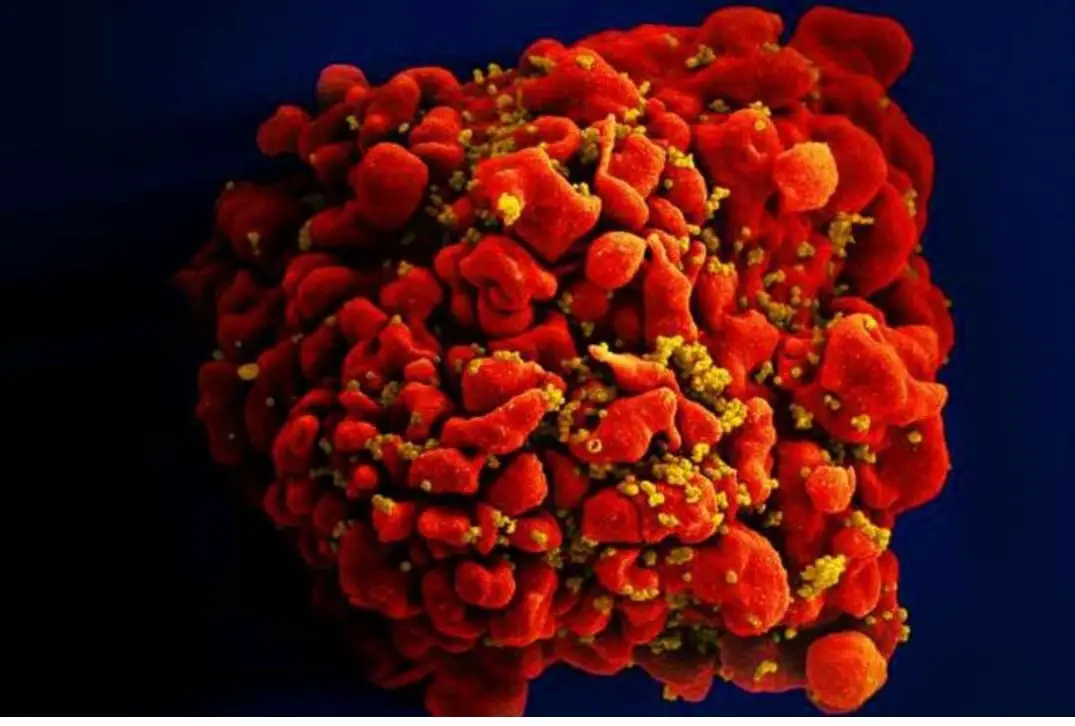
Gli scienziati hanno affermato che ogni dettaglio del viaggio dell’HIV attraverso il corpo è un’opportunità per trovare vulnerabilità che potrebbero essere colpite dallo sviluppo di farmaci. È anche uno sguardo in senso più ampio a un aspetto fondamentale della biologia.
“Penso che questo modello ci offra anche un nuovo modo per capire quante cose entrano nel nucleo , non solo l’HIV”, ha detto Voth.
Le simulazioni sono state eseguite presso il Texas Advanced Computing Center dell’Università del Texas ad Austin e il Research Computing Center di UChicago.
Il ricercatore medico dell’UNSW Dr. David Jacques e il suo team hanno scoperto come il virus dell’immunodeficienza umana penetra nel nucleo cellulare per stabilire l’infezione, una scoperta che ha implicazioni che vanno oltre la biologia dell’HIV.
Per infettare le cellule, l’HIV deve entrare nella cellula bersaglio e farsi strada verso il nucleo al centro della cellula dove possono essere prodotte copie sufficienti del suo codice genetico per infettare altre cellule.
Per completare in sicurezza questa missione, il virus costruisce un rivestimento proteico protettivo, un capside , per proteggersi dalle difese immunitarie dell’ospite intese a distruggerlo. Finora è rimasto un mistero il modo esatto in cui l’intero capside si muove attraverso i pori incorporati nell’involucro nucleare per entrare nel nucleo.
“Il complesso dei pori nucleari è costituito da una combinazione di proteine”, ha affermato l’autore senior dello studio, il dottor Jacques della Scuola di Scienze Biomediche dell’UNSW.
“Mentre le piccole molecole entrano ed escono dal nucleo attraverso il complesso dei pori nucleari, il traffico è limitato per i carichi ingombranti. Le proteine più grandi devono essere legate ai trasportatori nucleari, le proteine chaperone , che le trasportano attraverso la porta molecolare multistrato.”
Il capside dell’HIV, nonostante sia mille volte più grande delle dimensioni delle molecole che filtrano attraverso gli strati barriera, potrebbe passare nei canali di trasporto nucleare senza accompagnatori, ha dimostrato il team del dottor Jacques.
Le proteine chaperone, chiamate anche carioferine, interagiscono con le proteine al centro del complesso dei pori nucleari in un modo che consente loro di spostarsi con il loro carico utile in ogni strato successivo del cancello molecolare. Le strutture voluminose senza accompagnatori sono escluse da questo portale perché non sono in grado di connettersi con le proteine gatekeeper nel poro nucleare.
Il capside dell’HIV, tuttavia, si è evoluto per interagire con le proteine di barriera allo stesso modo delle proteine chaperone dell’ospite.
“Una delle teorie sul campo è che l’HIV dirotta un accompagnatore ospite per ottenere l’accesso al nucleo. Ma i nostri risultati mostrano che l’HIV non ha bisogno di un accompagnatore perché è il suo stesso accompagnatore. È come se il capside virale avesse imparato il segreto per essere ammessi in un’area riservata bisogna stringersi la mano imitando gli accompagnatori,” ha detto il dottor Jacques.
“Le persone hanno fatto delle ipotesi su come il capside avrebbe potuto superare la barriera selettiva. Il nostro lavoro sta davvero iniziando ad affrontare direttamente questo problema, e per me è entusiasmante”, ha affermato la dott.ssa Claire Dickson, co-autrice dello studio.
Le scoperte sono state rese possibili da un metodo a molecola singola sviluppato in precedenza dal team che ha permesso loro di selezionare sistematicamente le proteine del complesso dei pori nucleari per identificare quelle che interagivano con il capside intatto dell’HIV.
Il dottor Jacques è particolarmente entusiasta di riunire il know-how collettivo del suo team multidisciplinare in Australia e nel Regno Unito e l’infrastruttura cruciale disponibile presso l’UNSW.
“L’unico modo in cui siamo riusciti a realizzare questo progetto è stato attingere al Centro analitico Mark Wainwright dell’UNSW e alla competenza che hanno portato attraverso l’ampiezza delle diverse tecnologie e metodi di cui avevamo bisogno, tra cui la produzione di proteine, la biologia strutturale, l’imaging a super risoluzione e microscopia elettronica”, ha detto.
“Sono davvero orgogliosa di essere riuscita a superare alcune sfide importanti con questo progetto, di avere un impatto significativo nel campo della ricerca sull’HIV aiutando una migliore comprensione di questo processo”, ha affermato la co-autrice Dr. Sophie Hertel.
Secondo gli autori, la comprensione molecolare acquisita in questo studio sulle interazioni ospite-patogeno va oltre la scoperta dei dettagli del ciclo di vita dell’HIV. Questa conoscenza meccanicistica può essere sfruttata anche per altre applicazioni, inclusa la terapia genica.
“L’HIV è uno degli agenti patogeni più studiati, ma abbiamo ancora tanto da imparare da esso. C’è qualcosa di speciale nell’HIV: può penetrare nel nucleo senza danneggiarlo o dover attendere che la cellula si divida come gli altri virus. Le nostre osservazioni ci danno informazioni che ci permettono di pensare a come consegniamo il carico nel nucleo “, ha affermato il dottor Jacques.
Ogni anno, circa 1 milione di persone in tutto il mondo vengono infettate dall’HIV, il virus che causa l’AIDS. Per replicarsi e diffondere l’infezione, il virus deve introdurre di nascosto il suo materiale genetico nel nucleo della cellula e integrarlo in un cromosoma.
I gruppi di ricerca guidati da Dirk Görlich del Max Planck Institute for Multidisciplinary Science e Thomas Schwartz del Massachusetts Institute of Technology (MIT) hanno ora scoperto che il suo capside si è evoluto in un trasportatore molecolare. In quanto tale, può violare direttamente una barriera cruciale, che normalmente protegge il nucleo cellulare dagli invasori virali. Questa modalità di contrabbando mantiene il genoma virale invisibile ai sensori antivirali nel citoplasma. Il loro studio è pubblicato su Nature .
Quarant’anni dopo la scoperta del virus dell’immunodeficienza umana (HIV) come causa dell’AIDS, disponiamo di terapie che tengono efficacemente sotto controllo l’agente patogeno, ma non esiste ancora una cura. Il virus infetta alcune cellule immunitarie e dirotta il loro programma genetico per moltiplicare e replicare il proprio materiale genetico. Le cellule infette producono quindi la generazione successiva di virus fino a quando non vengono definitivamente distrutte. I sintomi di immunodeficienza dell’AIDS derivano dalla massiccia perdita di cellule immunitarie che normalmente combattono virus e altri agenti patogeni.
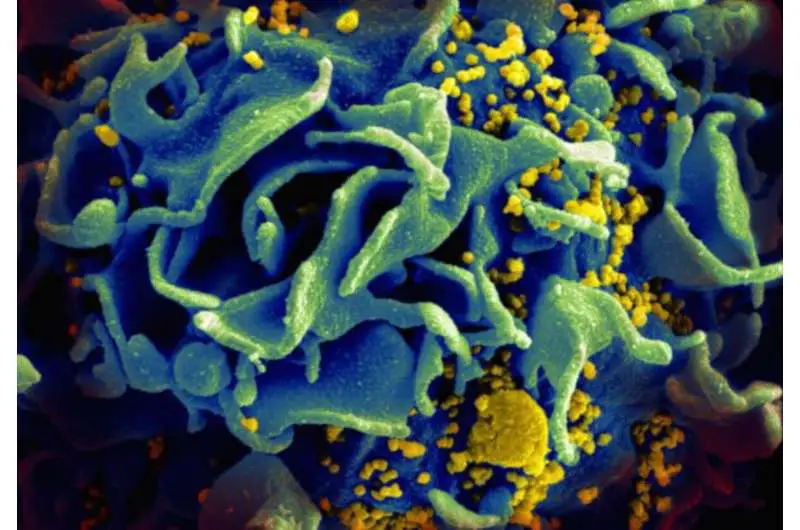
Per utilizzare le risorse della cellula ospite, l’HIV deve contrabbandare il suo materiale genetico attraverso le linee di difesa cellulare nel nucleo della cellula. Il nucleo, tuttavia, è strettamente sorvegliato. Il suo involucro nucleare impedisce a proteine indesiderate o virus dannosi di entrare nel nucleo e alle macromolecole da una fuga incontrollata. Tuttavia, le proteine selezionate possono passare perché la barriera non è sigillata ermeticamente.
Migliaia di minuscoli pori nucleari nell’involucro nucleare forniscono un passaggio. Controllano questi processi di trasporto con l’aiuto di importine ed esportazioni, trasportatori molecolari che catturano carichi con “codici di accesso” molecolari validi e li consegnano attraverso il canale dei pori nucleari. Un materiale “intelligente” trasforma questi pori in una delle macchine di smistamento e trasporto più efficienti della natura.
Questo materiale “intelligente”, chiamato fase FG, è gelatinoso e impenetrabile per la maggior parte delle macromolecole. Riempie e blocca il canale dei pori nucleari. Le importazioni e le esportazioni, tuttavia, possono passare perché le loro superfici sono ottimizzate per scorrere attraverso una fase FG.
Il controllo dei confini della cellula nella fase FG avviene in modo estremamente rapido, entro pochi millisecondi. Allo stesso modo, la sua capacità di trasporto è enorme: un singolo poro nucleare può trasferire fino a 1.000 trasportatori al secondo attraverso il suo canale. Anche con una densità di traffico così elevata, la barriera dei pori nucleari rimane intatta e continua a sopprimere i valichi di frontiera indesiderati. L’HIV, tuttavia, sovverte questo controllo.
“L’HIV impacchetta il suo genoma in un capside. Prove recenti suggeriscono che il genoma rimane all’interno del capside finché non raggiunge il nucleo, e quindi anche quando supera il poro nucleare. Ma c’è un problema di dimensioni”, spiega Thomas Schwartz del MIT. Il canale del poro centrale è largo da 40 a 60 nanometri. Il capside ha una larghezza di circa 60 nanometri e potrebbe passare attraverso i pori.
Tuttavia, un normale carico cellulare sarebbe comunque coperto da uno strato trasportatore che aggiunge almeno altri dieci nanometri. Il capside dell’HIV sarebbe quindi largo 70 nanometri, troppo grande per un poro nucleare. “Tuttavia, la tomografia crioelettronica ha dimostrato che il capside dell’HIV penetra nel poro nucleare. Ma come ciò avvenga è stato finora un mistero nell’infezione da HIV”, afferma Görlich, direttore del Max Planck.
Insieme a Schwartz, Görlich ha ora scoperto come il virus supera il suo problema di dimensioni, ovvero attraverso un sofisticato adattamento molecolare. “Il capside dell’HIV si è evoluto in un trasportatore con una superficie simile all’importina. In questo modo può scivolare attraverso la fase FG del poro nucleare. Il capside dell’HIV può quindi entrare nel poro nucleare senza aiutare i trasportatori e bypassare il meccanismo protettivo che altrimenti impedisce ai virus di invadere il nucleo cellulare”, spiega il biochimico.
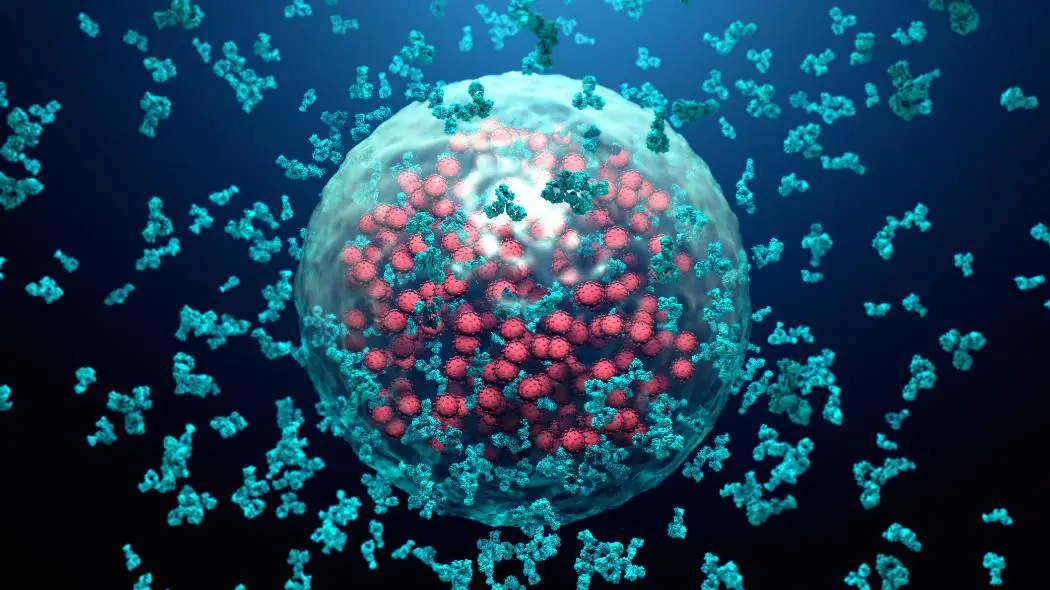
Il suo team è riuscito a riprodurre le fasi FG in laboratorio. “Al microscopio, le fasi FG appaiono come sfere di dimensioni micrometriche che escludono completamente le proteine normali, ma praticamente risucchiano il capside dell’HIV con il suo contenuto racchiuso”, riferisce Liran Fu, uno dei primi autori dello studio. “Allo stesso modo, il capside viene risucchiato nel canale dei pori nucleari . Ciò accade anche dopo che tutti i trasportatori cellulari sono stati rimossi.”
Sotto un aspetto il capside dell’HIV differisce fondamentalmente dai trasportatori precedentemente studiati che attraversano i pori nucleari: incapsula completamente il suo carico e quindi nasconde il suo carico utile genomico ai sensori antivirali nel citoplasma. Utilizzando questo trucco, il materiale genetico virale può essere introdotto di nascosto attraverso il sistema di difesa virale cellulare senza essere riconosciuto e distrutto. “Ciò la rende un’altra classe di trasportatori molecolari accanto alle importine e alle esportazioni”, sottolinea Görlich.
Ci sono ancora molte domande senza risposta, come dove e come il capside si disintegra per rilasciare il suo contenuto. Tuttavia, l’osservazione che il capside è un trasportatore simile all’importina potrebbe un giorno essere sfruttata per migliori terapie contro l’AIDS.