I procedimenti molecolari generati da una mutazione del gene TREM2 (Triggering Receptor Expressed on Myeloid Cells 2) nelle cellule immunitarie della microglia del cervello possono potenziare il rischio di incorrere in una diagnosi di morbo di Alzheimer. A dichiararlo sono ricercatori dell’Università della California, a Irvine, in una recente ricerca.
Sebbene molti geni delle cellule immunitarie siano stati associati all’Alzheimer, le probabilità sono aumentate da due a tre volte dalle mutazioni in TREM2. Tuttavia, i processi mediante i quali queste mutazioni cambiano la funzione delle cellule della microglia, ad oggi, non sono stati individuati.
I risultati dello studio sono stati pubblicati sulla rivista eLife.
Mutazione del gene TREM2 e Morbo di Alzheimer: ecco cosa dice la ricerca
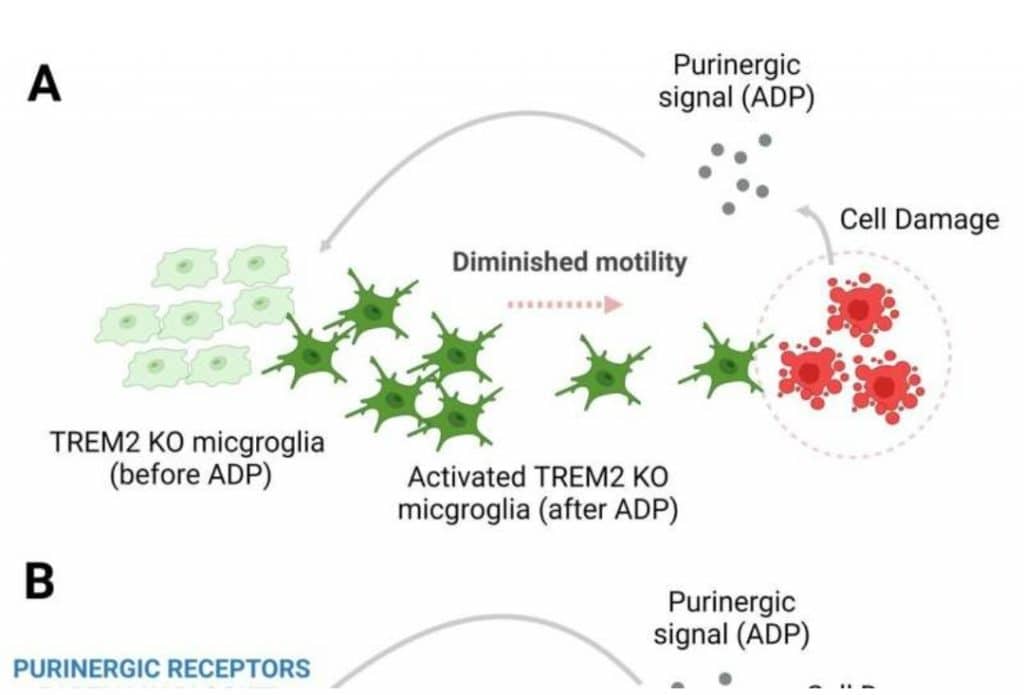
Una funzione fondamentale della microglia è quella di ripristinare la salute del cervello. Gli studiosi hanno fatto riferimento a una loro ricerca pregressa che ha evidenziato come le microglia prive di TREM2 avessero problemi a spostarsi verso i siti di danno nel cervello.
Gli scienziati coinvolti nello studio hanno rivelato che questa mancanza di motilità è associata a livelli aumentati di recettori P2RY12 e P2RY13 sulla microglia. Quando questi recettori rilevano segnali di pericolo molecolare purinergici rilasciati dalle cellule danneggiate vicine, aumentano rapidamente il calcio messaggero interno all’interno della microglia. Le microglia contenenti livelli di calcio più elevati non si muovono così frequentemente e quindi non possono dirigersi verso i siti della lesione.
“Il nostro studio mostra che i problemi derivano dall’avere troppa segnalazione tra i recettori P2RY12 e P2RY13. Siamo stati in grado di riportare le cellule immunitarie della microglia alla loro normale funzione bloccando questi recettori. Ciò suggerisce che i pazienti di Alzheimer che hanno mutazioni nella proteina TREM2 sarebbero beneficiare dell’inibizione di questi recettori o delle relative molecole di segnalazione. Manipolare il calcio usando farmaci potrebbe essere un altro modo per modulare il comportamento della microglia per combattere le malattie“, ha affermato Michael D. Cahalan, ricercatore nel Physiology & Biophysics, illustre professore e presidente della UCI School di Medicina, e co-autore corrispondente.
Il team ha utilizzato un modello di coltura di microglia derivato da cellule staminali pluripotenti indotte dall’uomo dal sangue per studiare la mancanza di TREM2. In quelle cellule è stata ingegnerizzata una speciale sonda di calcio chiamata Salsa6f, che ha permesso di misurare il calcio registrando le caratteristiche della motilità in tempo reale.
“Il morbo di Alzheimer è la causa più comune di demenza e attualmente non ha cura“, ha spiegato Cahalan: “Gli studi sul DNA di persone con Alzheimer hanno sorprendentemente rivelato che i cambiamenti ai geni nella microglia possono avere un grande impatto sul fatto che qualcuno abbia o meno la malattia. Comprendere i processi di come queste mutazioni cambiano la funzione delle cellule immunitarie ci consentirà di sviluppare terapie mirate”.
Lo studioso post-dottorato dell’UCI Amit Jairaman e la dottoranda Amanda McQuade, che ora è una borsista post-dottorato presso l’UCSF, sono i primi co-autori dello studio.
La scoperta di TREM2 come gene di rischio per la malattia di Alzheimer (AD) mieloide ha accelerato la ricerca sul ruolo della microglia non questa terribile patologia. Sebbene i modelli murini TREM2 abbiano fornito informazioni critiche, le funzioni normali e associate alla malattia di TREM2 nella microglia umana rimangono poco chiare.
Per poter trovare risposte su questa incertezza, un punto di partenza è quello di profilate la microglia differenziata dalle linee di cellule staminali pluripotenti (iPSC) indotte da TREM2 modificate con CRISPR. Combinando analisi trascrittomiche e funzionali con un modello murino chimerico di AD, scopriamo che la delezione di TREM2 riduce la sopravvivenza della microglia, altera la fagocitosi di substrati chiave tra cui APOE e inibisce la chemiotassi mediata da SDF-1α/CXCR4, culminando in una risposta alterata all’amiloide-beta placche in vivo.
Il sequenziamento a cellula singola della microglia umana xenotrapiantata evidenzia ulteriormente una perdita di risposte microgliali associate alla malattia (DAM) nella microglia knockout TREM2 umana che convalidiamo mediante citometria a flusso e immunoistochimica. Presi insieme, questi studi rivelano aspetti sia conservati che nuovi della biologia umana TREM2 che probabilmente svolgono ruoli critici nello sviluppo e nella progressione del morbo di Alzheimer.