Un’équipe di scienziati del Salk Institute e dell’UC San Diego hanno studiato attentamente, in una recente ricerca, i globuli umani e hanno scoperto un sorprendente legame tra DNA mitocondriale, infiammazione e DNMT3A e TET2, due geni che normalmente aiutano a regolare la crescita dei globuli ma, una volta mutati, vengono associati ad un aumentato rischio di aterosclerosi.
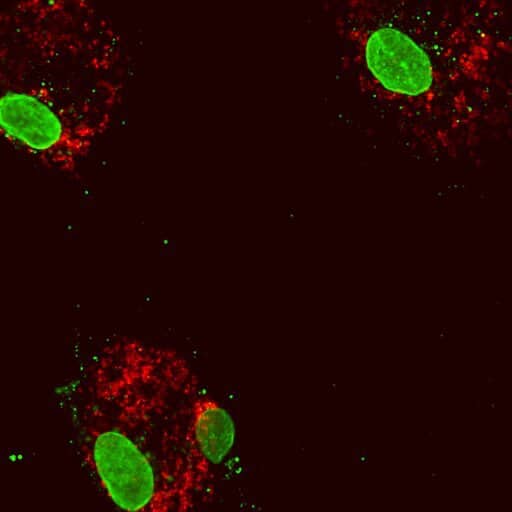
I risultati della ricerca sono stati pubblicati sulla rivista scientifica Immunity.
DNA mitocondriale e rischio aumentato di incorrere nell’aterosclerosi: ecco in cosa consiste la correlazione
I mitocondri sono conosciuti come centrali elettriche delle cellule, ma prove crescenti suggeriscono che svolgono anche un ruolo nell’infiammazione: “Abbiamo scoperto che i geni DNMT3A e TET2, oltre al loro normale compito di alterare i tag chimici per regolare il DNA, attivano direttamente l’espressione di un gene coinvolto nelle vie infiammatorie del DNA mitocondriale, il che suggerisce un nuovo bersaglio molecolare per la terapia dell’aterosclerosi“, ha dichiarato Gerald Shadel, co-autore senior, Professore di Salk e Direttore del Nathan Shock Center of Excellence in the Basic Biology of Aging di San Diego.
La ricerca ha avuto inizio quando una squadra di scienziati dell’UC San Diego ha notato una risposta infiammatoria specifica mentre studiavano i ruoli delle mutazioni DNMT3A e TET2 nell’ematopoiesi clonale, quando cellule del sangue immature mutate danno origine a una popolazione di cellule del sangue mature con mutazioni identiche. I ricercatori hanno osservato che la segnalazione infiammatoria anormale era anche correlata alla carenza di DNMT3A e TET2 nei globuli che svolgono un ruolo importante nella risposta infiammatoria che promuove la progressione dell’aterosclerosi.
Non era ancora chiaro tuttavia come i geni DNMT3A e TET2 fossero coinvolti nell’infiammazione e forse nell’aterosclerosi: “Il problema era che non riuscivamo a capire come fossero coinvolti DNMT3A e TET2 perché le proteine che codificano fanno cose apparentemente opposte per quanto riguarda la regolazione del DNA“, ha affermato Christopher Glass, coautore senior e Professore presso la UC San Diego School of Medicine.
“La loro attività antagonista ci ha portato a credere che potrebbero esserci altri meccanismi in gioco. Questo ci ha spinto ad adottare un approccio diverso e a contattare Shadel, che aveva scoperto lo stesso percorso infiammatorio anni prima mentre esaminava le risposte allo stress del DNA mitocondriale“, ha continuato lo scienziato.
All’interno dei mitocondri risiede un sottoinsieme unico del DNA della cellula che deve essere organizzato e condensato correttamente per sostenere la normale funzione. Il team di Shadel ha precedentemente studiato gli effetti dello stress del DNA mitocondriale rimuovendo il TFAM, un gene che aiuta a garantire che il DNA mitocondriale sia confezionato correttamente.
I ricercatori hanno scoperto che quando i livelli di TFAM si riducono, il DNA mitocondriale viene espulso dai mitocondri all’interno della cellula. Questo innesca lo stesso allarme molecolare che dice alla cellula che c’è un invasore batterico o virale e innesca un percorso molecolare difensivo che promuove l’infiammazione.
Gli scienziati dei laboratori Glass e Shadel hanno lavorato insieme per capire meglio perché le mutazioni DNMT3A e TET2 hanno portato a risposte infiammatorie simili a quelle osservate durante lo stress del DNA mitocondriale. le squadre di scienziati hanno applicato strumenti di ingegneria genetica e imaging cellulare per esaminare le cellule di persone con cellule normali, quelle con mutazioni con perdita di funzione nell’espressione di DNMT3A o TET2 e quelle con aterosclerosi.
Un questo modo, gli studiosi hanno scoperto che la riduzione sperimentale dell’espressione di DNMT3A o TET2 nei globuli normali ha avuto risultati simili alle cellule del sangue che avevano mutazioni con perdita di funzione e cellule del sangue da pazienti con aterosclerosi, un aumento della risposta infiammatoria. Sorprendentemente, bassi livelli di espressione di DNMT3A e TET2 nelle cellule del sangue portano a una ridotta espressione di TFAM, che a sua volta porta a un confezionamento anormale del DNA dei mitocondri, istigando l’infiammazione a causa del DNA mitocondriale rilasciato.
“Abbiamo scoperto che le mutazioni DNMT3A e TET2 impediscono la loro capacità di legare e attivare il gene TFAM“, ha spiegato il primo autore Isidoro Cobo, ricercatore post-dottorato nel laboratorio Glass presso l’UC San Diego: “Mancare o ridurre questa attività di legame porta al rilascio del DNA mitocondriale e a una risposta infiammatoria mitocondriale iperattiva e riteniamo che ciò possa esacerbare l’accumulo di placca nell’aterosclerosi“.
“È molto emozionante vedere che la nostra scoperta sull’esaurimento del TFAM che causa stress e infiammazione del DNA mitocondriale ora ha una rilevanza diretta per una malattia come l’aterosclerosi“, ha aggiunto Shadel, che detiene la cattedra Audrey Geisel in Scienze biomediche: “Da quando abbiamo rivelato questo percorso, c’è stata un’esplosione di interesse per i mitocondri coinvolti nell’infiammazione e molti rapporti che collegano il rilascio del DNA mitocondriale ad altri contesti clinici“.
Esistono già terapie che prendono di mira le vie di segnalazione dell’infiammazione per altre patologie. Glass e Shadel ritengono che il blocco dei percorsi che esacerbano l’aterosclerosi nei pazienti con mutazioni TET2A e DNMT3A potrebbe costituire la base per nuovi trattamenti. Successivamente, gli scienziati continueranno a studiare questo percorso e a sondare il modo in cui il DNA mitocondriale è coinvolto in altre malattie umane e nell’invecchiamento.
Altri autori includevano Kailash Chandra Mangalhara di Salk; Tiffany N. Tanaka, Addison Lana, Calvin Yeang, Claudia Han, Johannes Schlachetzki, Jean Challcombe, Bethany R. Fixsen, Mashito Sakai, Rick Z. Li, Hannah Fields, Randy G. Tsai e Rafael Bejar dell’UC San Diego; Michael Mokry dell’ospedale pediatrico Wilhelmina nei Paesi Bassi; Koen Prange e Menno de Winther dell’Università di Amsterdam.