Nei disturbi cerebrali come l’Alzheimer, è conosciuta la degenerazione delle sinapsi, che contengono le nostre memorie, si rompono troppo presto e scompaiono. Si pensa che questa degenerazione delle sinapsi inizi molto prima della perdita di memoria e acceleri con il progredire delle malattie.
Le cause di questa forma di degenerazione nei disturbi neurodegenerativi non sono state ben comprese, principalmente perché gli scienziati non hanno ancora svelato i meccanismi chiave che normalmente tengono insieme queste minuscole strutture (una media di un micrometro di diametro) per tutta la vita.
I cervelli adulti sani invece sono dotati di un vasto numero di sinapsi, strutture che trasmettono segnali attraverso le cellule nervose per consentire comunicazioni, elaborazione e memorizzazione delle informazioni in tutto il sistema nervoso. A parte i periodi dinamici in cui il cervello sta imparando nuove informazioni o abilità, il numero delle sinapsi “glutamatergiche”, il principale tipo di sinapsi che i neuroni usano per attivarsi a vicenda, rimane in gran parte costante negli adulti.
I risultati della ricerca sono stati pubblicati sulla rivista scientifica Science Advances.
Degenerazione delle sinapsi: scoperti i meccanismi chiavi
I neurobiologi dell’Università della California a San Diego hanno scoperto i meccanismi a lungo ricercati alla base del mantenimento delle sinapsi glutamatergiche. Sulla base di questa scoperta fondamentale, Bo Feng, borsista post-dottorato della Divisione di Scienze Biologiche, il professor Yimin Zou e i loro colleghi hanno identificato i componenti principali che guidano la degenerazione della sinapsi associata all’amiloide beta. Le beta amiloidi sono peptidi di 36-43 amminoacidi derivati dalla proteina precursore dell’amiloide (APP) e sono il componente principale delle placche amiloidi presenti nel cervello delle persone con malattia di Alzheimer.
Nonostante l’enorme mole di studi e ricerche, la scoperta di farmaci per l’Alzheimer non ha avuto successo. Finora, gli approcci principali sono stati ridurre la produzione di beta amiloide o eliminare le placche di beta amiloide. La nuova scoperta dei ricercatori della UC San Diego, suggerisce un approccio alternativo più a valle: proteggere le sinapsi bloccando direttamente le azioni tossiche dell’amiloide-beta.
Le sinapsi glutamatergiche sono strutture altamente polarizzate con una parte presinaptica da una cellula nervosa e una parte postsinaptica da un’altra. Questo tipo di polarità garantisce la corretta direzione del flusso di informazioni.
Il laboratorio di Zou aveva precedentemente scoperto che durante lo sviluppo del cervello le strutture sinaptiche altamente polarizzate sono assemblate da componenti della via della polarità cellulare planare (PCP): una potente via di segnalazione che polarizza le giunzioni cellula-cellula lungo il piano del tessuto.
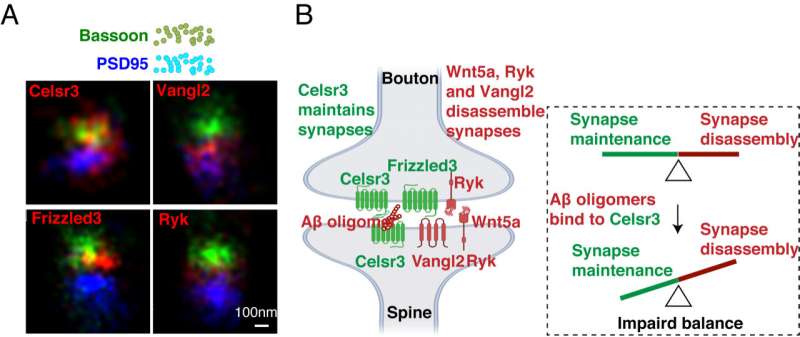
Utilizzando la microscopia a super risoluzione, i ricercatori hanno rilevato la posizione precisa di questi stessi componenti di segnalazione PCP, chiamati Celsr3, Frizzled3 e Vangl2, nelle sinapsi glutamatergiche nel cervello adulto. Hanno poi scoperto che la rimozione di questi componenti, essenziali per l’assemblaggio iniziale delle sinapsi dai neuroni adulti, può alterare drasticamente il numero di sinapsi.
Incoraggiati dal fatto che questi componenti siano coinvolti nella degenerazione delle sinapsi, hanno testato se l’amiloide-beta, un fattore chiave della perdita di sinapsi nella malattia di Alzheimer, influenza la funzione o l’interazione di queste proteine. In una serie di esperimenti, hanno dimostrato che gli oligomeri beta amiloide si legano a Celsr3 e consentono a Vangl2 di disassemblare più efficacemente le sinapsi, probabilmente indebolendo le interazioni tra Celsr3 e Frizzled3.
“È come se l’amiloide-beta avesse scoperto da tempo il tallone d’Achille delle nostre sinapsi”, ha detto Zou, professore nella Sezione di Neurobiologia, Divisione di Scienze Biologiche.
Una volta che i ricercatori hanno rimosso Vangl2 dai neuroni, hanno scoperto che l’amiloide-beta non può più causare la degenerazione delle sinapsi sia nelle colture neuronali che negli animali esposti agli oligomeri dell’amiloide-beta. Ryk, un regolatore della via PCP che interagisce con Frizzled3 e Vangl2, si trova anche presente nelle sinapsi adulte e funziona allo stesso modo di Vangl2 per mediare il disassemblaggio delle sinapsi. I ricercatori hanno scoperto che bloccare Ryk utilizzando anticorpi bloccanti la funzione può proteggere le sinapsi dalla degenerazione indotta dall’amiloide-beta.
Per testare ulteriormente l’ipotesi che questa via di segnalazione fondamentale sia un obiettivo primario della degenerazione delle sinapsi nella malattia di Alzheimer, il laboratorio Zou ha utilizzato topi 5XFAD, un noto modello murino con patologia dell’amiloide-beta. Questo topo transgenico è portatore di cinque mutazioni umane che causano il morbo di Alzheimer e quindi mostra gravi sintomi di degenerazione delle sinapsi e perdita delle funzioni cognitive.
Gli esperti hanno scoperto che la rimozione di Ryk tramite knockout genico dai neuroni adulti proteggeva le sinapsi e preservava la funzione cognitiva dei topi 5XFAD. L’infusione della funzione che blocca l’anticorpo Ryk ha anche protetto le sinapsi e ha preservato la funzione cognitiva nei topi 5XFAD, suggerendo che l’anticorpo Ryk è un potenziale agente terapeutico.
Questi risultati incoraggianti suggeriscono che il percorso della PCP è un bersaglio diretto della perdita di sinapsi indotta dalla beta amiloide nella malattia di Alzheimer.
“Poiché la patologia dell’amiloide-beta e la perdita di sinapsi di solito si verificano nelle prime fasi dell’Alzheimer, anche prima che il declino cognitivo possa essere rilevato, un intervento precoce, come ripristinare il riequilibrio del percorso del PCP, sarà probabilmente utile per i malati di Alzheimer”, ha detto Zou.
La neuroinfiammazione, riflessa dall’attivazione di astrociti e microglia, è anche un segno distintivo della patologia di Alzheimer, che può essere indotta dall’accumulo di beta amiloide ed è noto per accelerare la perdita di sinapsi. In modo interessante, il laboratorio Zou ha scoperto che l’anticorpo Ryk può anche bloccare l’attivazione di astrociti e microglia nei topi 5XFAD.
Sebbene non siano in grado di distinguere se ciò sia dovuto all’effetto indiretto della protezione delle sinapsi o al blocco delle funzioni di Ryk nell’infiammazione, o entrambi, Zou ritiene che i risultati siano coerenti con il miglioramento del comportamento cognitivo e supportino ulteriormente Ryk come potenziale bersaglio terapeutico per entrambi proteggere le sinapsi e ridurre l’infiammazione nella malattia di Alzheimer.
“Questa scoperta può essere applicabile alla degenerazione delle sinapsi in generale poiché i componenti del PCP possono essere i bersagli sinaptici diretti che mediano la perdita di sinapsi in altri disturbi neurodegenerativi, come il morbo di Parkinson e la sclerosi laterale amiotrofica (malattia di Lou Gehrig)”, ha concluso Zou.