Da rodospine a cryorodopsine è un attimo: ma andiamo con ordine.
Dimentica per un attimo il caldo torrido: immagina i ghiacciai della Groenlandia, le nevi perenni dell’Himalaya e le sorgenti sotterranee ghiacciate della Finlandia; in questi ambienti estremi si nasconde qualcosa di ben più affascinante della semplice bellezza naturale: molecole sconosciute che potrebbero cambiare il modo in cui controlliamo l’attività del cervello umano.
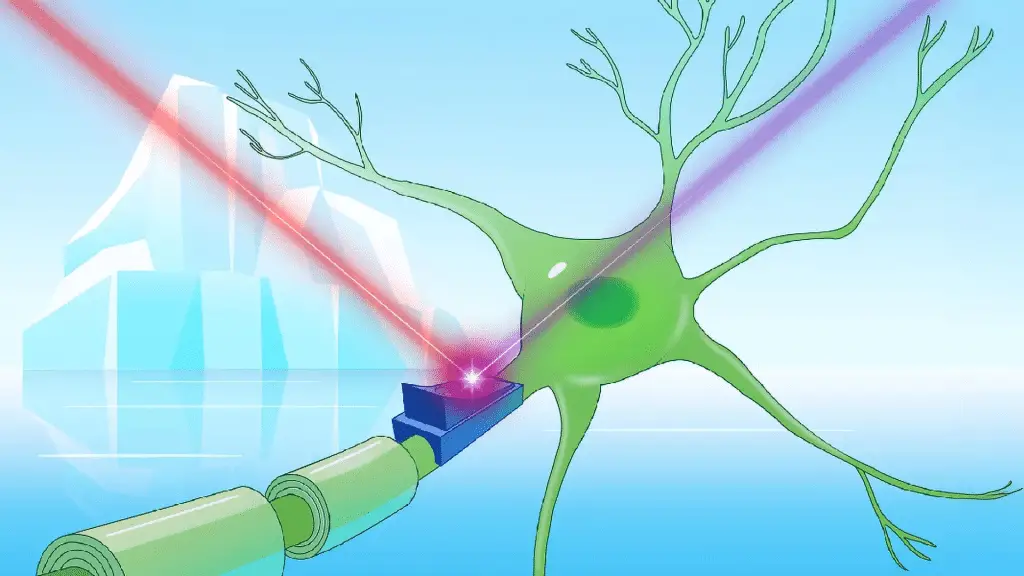
È ciò che ha scoperto Kirill Kovalev, fisico e ricercatore post-doc EIPOD presso EMBL Amburgo (gruppo Schneider) e EMBL-EBI (gruppo Bateman). Da anni studia le rodopsine, proteine sensibili alla luce presenti in alcuni microrganismi acquatici, usate anche in optogenetica per attivare e disattivare neuroni con impulsi luminosi: ma quello che ha trovato sfogliando un database online ha dell’incredibile.
Rodopsine… nel ghiaccio: ossia cryorodopsine?
Durante una consultazione casuale di banche dati proteiche, Kovalev ha notato un pattern: un gruppo di rodopsine identiche, ma localizzate solo in ambienti freddi e remoti; da lì il nome: cryorodopsine, letteralmente “rodopsine del freddo”.
Queste proteine erano stranamente simili tra loro pur essendosi evolute in ambienti geograficamente molto distanti; eppure non sembravano condividere la funzione classica delle rodopsine marine. Un segnale troppo chiaro per essere ignorato: queste molecole avevano un compito diverso. Ma quale?
Il colore come codice molecolare
Ogni rodopsina riflette un certo tipo di luce: la maggior parte è rosa-arancio, quindi assorbe blu e verde; le cryorodopsine, invece, mostravano una gamma cromatica inaspettata, comprese varianti blu, molto ricercate in optogenetica per la loro capacità di essere attivate da luce rossa, ossia la più adatta a penetrare in profondità nei tessuti senza danneggiarli.
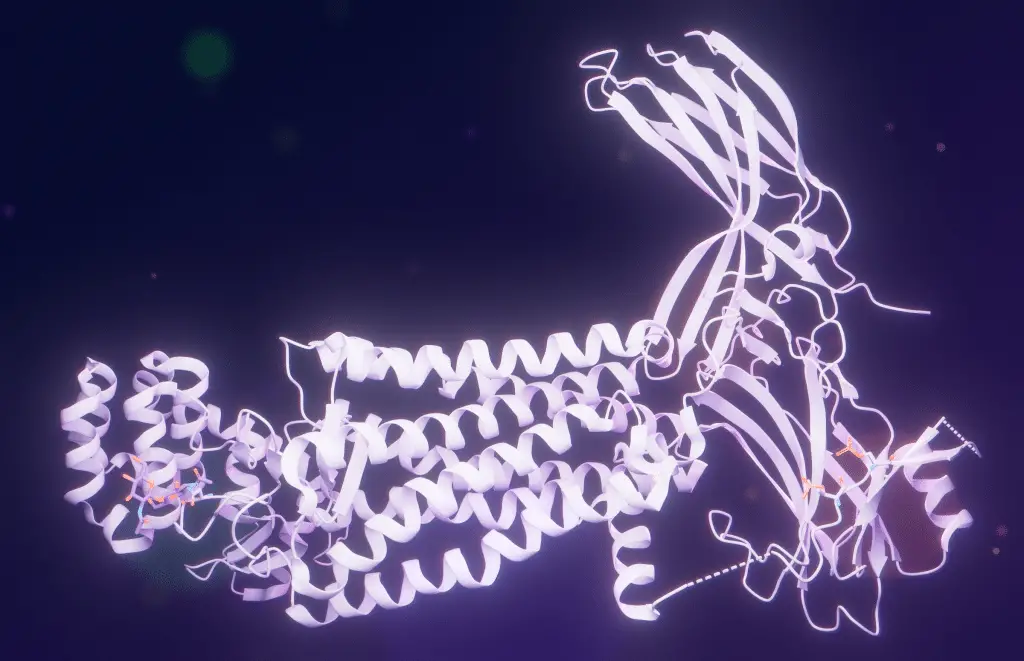
Kovalev ha scoperto che una specifica variazione strutturale rara era alla base di questo comportamento. Comprendere questa proprietà ha aperto la porta a un passo fondamentale: progettare artificialmente rodopsine blu per applicazioni mediche, biotecnologiche o persino neurali.
Sperimentazione su cellule cerebrali
Ma la vera sorpresa è arrivata testando le cryorodopsine su cellule cerebrali coltivate. Quando irradiate con luce UV, le cellule attivate da queste proteine generavano impulsi elettrici. A seconda della lunghezza d’onda successiva (verde o rosso/UV), l’eccitabilità neuronale aumentava o diminuiva.
In parole povere: una singola proteina capace sia di accendere che spegnere un neurone, potenzialmente più versatile delle attuali soluzioni optogenetiche.

Tobias Moser, dell’Università Medica di Göttingen, ha già intravisto le potenzialità per la sua ricerca: “Nel nostro gruppo stiamo sviluppando impianti cocleari ottici. Cryorodopsine multiuso potrebbero aprire nuove possibilità per ripristinare l’udito attraverso la luce“.
Sensori UV evoluti?
Ma c’è di più: le cryorodopsine sembrano agire anche come sensori di luce UV proprietà mai osservata finora in altri tipi di rodopsine. In condizioni sperimentali, sono risultate le più lente a reagire alla luce, suggerendo un ruolo sensoriale piuttosto che energetico.
Ulteriori analisi condotte con il supporto dell’intelligenza artificiale AlphaFold hanno individuato accanto al gene cryorodopsin una minuscola proteina misteriosa: un potenziale “messaggero” cellulare, forse pronto a trasmettere il segnale UV verso l’interno della cellula.

La struttura predetta? Un anello proteico a cinque unità, posizionato a stretto contatto con la cryorodopsina.
Se confermato, questo meccanismo rappresenterebbe una nuova via di comunicazione intracellulare mediata dalla luce.
Perché solo al freddo?
Kovalev ipotizza che queste proteine non si siano evolute per resistere al freddo, ma per proteggere i batteri dai raggi UV. In alta montagna o nei ghiacci polari, dove l’atmosfera è più sottile, la radiazione solare può essere micidiale. Le cryorodopsine, quindi, potrebbero aver dato a questi microrganismi la capacità di “vedere” il pericolo e reagire.
Un progetto reso possibile dalla tecnologia
Per ottenere questi risultati, Kovalev ha sfruttato un approccio integrato di biologia strutturale 4D: cristallografia a raggi X presso la beamline P14 di EMBL Amburgo, microscopia crioelettronica (cryo-EM) a Groningen (Paesi Bassi) e spettroscopia avanzata. Tutto eseguito con un livello di precisione tale da rilevare la posizione di singoli atomi.
L’unico ostacolo? Le cryorodopsine sono estremamente sensibili alla luce, quindi molti esperimenti si sono dovuti condurre quasi al buio totale.