I ricercatori della Pohang University of Science and Technology in Corea hanno sviluppato i cerotti cardiaci in 3D ricavati da cellule staminali. Le malattie cardiovascolari infatti rappresentano il 32% dei decessi in tutto il mondo. L’infarto del miocardio ha un ruolo importante nelle malattie cardiache e nella necrosi del tessuto cardiaco dopo che l’afflusso di sangue è diminuito o interrotto.
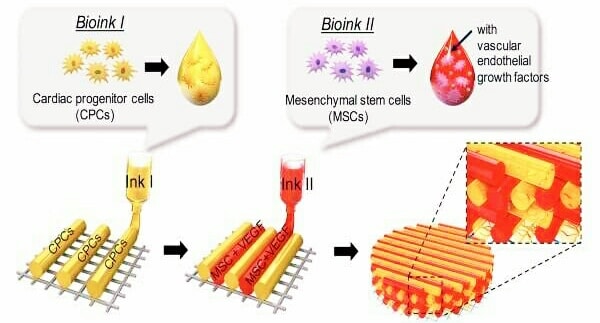
Le tecnologie di patch cardiache biostampate in 3D cariche di cellule staminali e sulla loro efficacia come approccio terapeutico e rigenerativo per la cardiomiopatia ischemica nell’invertire la formazione di cicatrici e promuovere la rigenerazione del miocardio, sono oggetto di studio con risultati che promettono bene.
Lo studio è stato pubblicato su APL Bioengineering.
Cerotti cardiaci in 3D: un’alternativa promettente per la riparazione del miocardio
“Le terapie attualmente disponibili non sono sufficienti per il trattamento completo dell’infarto del miocardio”, ha dichiarato l’autore Jinah Jang. “È urgentemente necessario lo sviluppo di una nuova modalità avanzata, come la riduzione del rimodellamento cardiaco avverso, la promozione delle funzioni miocardiche e la correzione di difetti molecolari o genetici”.
I ricercatori hanno indagato su vari tipi di cellule staminali candidate che possiedono un potenziale rigenerativo cardiaco, spiegando le loro applicazioni e limitazioni. il team di ricerca si è concentrato sull’implementazione impegnativa dell’approccio di bioprinting 3D all’avanguardia per fabbricare cerotti cardiaci in 3D ed evidenziare diverse strategie per implementare la vascolarizzazione e aumentare le proprietà funzionali cardiache rispetto alle somiglianze elettrofisiologiche con il tessuto nativo.
A seguito di un infarto miocardico, i tessuti e i vasi del miocardio sono ugualmente e gravemente danneggiati. Pertanto, dovrebbero essere pianificati approcci terapeutici o rigenerativi per mirare a entrambi contemporaneamente per ottenere una riparazione cardiaca di successo, poiché il cuore ha pochissima capacità di rigenerare cardiomiociti o cellule cardiache da solo.
L’utilizzo della tecnologia di biostampa 3D per controllare geometricamente il modello spaziale e l’utilizzo della doppia terapia con cellule staminali come co-coltura può svolgere un ruolo importante nel promuovere e migliorare sinergicamente la vascolarizzazione e la funzione cardiaca dopo l’ infarto miocardico.
Le terapie con cellule staminali a base di cerotti che vengono impiegate oggi, hanno rivelato un’efficacia avanzata, piuttosto che utilizzare terapie a componente singolo, fornendo un ambiente favorevole ai tessuti durante il periodo di integrazione ospite-innesto: “Sarebbe utile tracciare le cellule del cerotto stampato per indagare sulla modalità di azione del cerotto trapiantato”, ha affermato l’autore Sanskrita Das.
“Sebbene ci siano ancora limitazioni intrinseche per lo studio clinico, la tecnologia della piattaforma di consegna delle cellule staminali suggerita fornisce una prospettiva terapeutica pratica per varie applicazioni di ingegneria dei tessuti“, ha affermato l’autore Hyoryung Nam.
Gli studi e l’impegno per la rigenerazione cardiaca e la scienza continuano ad andare avanti: i cerotti cardiaci in 3D biostampati diventeranno presto una possibilità da proporre al paziente sempre più fattibile, praticabile e funzionale, sbloccando le barriere per ottenere le proprietà dei cardiomiociti. Questo aprirà nuove frontiere per la ricerca cardiaca, aprendo la strada a nuovi trattamenti per i pazienti con malattie cardiovascolari.
Ci sono altri metodi per curare le cicatrici del miocardio, oltre ai cerotti cardiaci in 3D?
Si stima che durante un infarto si perdano un miliardo di cellule del cuore. A causa dell’infarto, il tessuto perso viene sostituito da tessuto cicatriziale, che può portare a insufficienza cardiaca, aritmia e morte. In uba ricerca portata avanti dagli esperti dell’Università di Tsukuba è stato dimostrato come le cellule del tessuto cicatriziale possono essere convertite in cellule del muscolo cardiaco, rigenerando efficacemente il cuore ferito.
Il cuore ferito di umani e roditori allo stesso modo non ha la capacità di rigenerarsi dopo l’infortunio. Pertanto, l’unica strada per il cuore di guarire la ferita è costruire un tessuto cicatriziale nell’area lesa. La ricerca, da sempre, è concentrata sulla possibilità riprogrammare i fibroblasti, le cellule che producono il tessuto connettivo in una cicatrice, ai cardiomiociti, le cellule del muscolo cardiaco che lavorano. L’obiettivo del mondo scientifico è di avere la possibilità di sostituire le cellule cardiache, così che anche i cerotti cardiaci in 3D non siano l’unica alternativa, e prevenendo anche l’insufficienza cardiaca che potrebbe portare ad un decorso infausto.
Ricerche precedenti hanno evidenziato che i cardiomiociti sembrano formarsi iniettando direttamente un virus innocuo che trasporta una serie di fattori di trascrizione cardiaca , proteine che guidano l’espressione di geni di cui le cellule del muscolo cardiaco hanno bisogno per il loro sviluppo e funzione, nel cuore dei roditori dopo un cuore attacco. Tuttavia, l’origine e il significato funzionale di queste cellule muscolari cardiache appena formate non sono ancora stati determinati in modo inequivocabile.
“La riprogrammazione cardiaca diretta ha un grande potenziale per la rigenerazione cardiaca e il trattamento dell’infarto del miocardio“, afferma l’autore principale dello studio, il professor Masaki Ieda. “Tuttavia, quando vengono introdotti fattori di trascrizione, i cardiomiociti apparenti possono essere formati convertendo i fibroblasti in nuovi cardiomiociti o fondendo i fibroblasti con i cardiomiociti esistenti. La differenza è che solo il primo processo, che chiamiamo ‘riprogrammazione diretta’, contribuisce in modo significativo alla rigenerazione In questo studio, il nostro obiettivo era determinare come si formano nuovi cardiomiociti quando vengono introdotti fattori di trascrizione cardiaca dopo infarto miocardico”.
Per raggiungere il loro obiettivo, i ricercatori hanno prima generato topi in cui tutte le cellule emettevano fluorescenza rossa: le cavie sono state modificate in modo che i fibroblasti emettessero fluorescenza verde dopo il trattamento con il farmaco tamoxifene. Di conseguenza, osservando il cuore dopo il trattamento con tamoxifene, le cellule che emettevano fluorescenza sia rossa che verde indicavano che era avvenuta la fusione cellulare tra fibroblasti e cardiomiociti. Al contrario, la presenza di fluorescenza verde indicava che si era verificata una riprogrammazione diretta dei fibroblasti a cardiomiociti.
i ricercatori, equipaggiati con le tecnologie necessarie, hanno utilizzato un modello murino con infarto e hanno trattato i topi con tamoxifene. Sebbene non vi fosse alcuna riprogrammazione diretta in un gruppo di controllo, gli scienziati hanno rintracciato l’1-1,5% di cellule riprogrammate direttamente quando un virus che trasporta fattori di trascrizione cardiaca è stato iniettato nei topi. Entrambi i gruppi hanno mostrato una fusione cellulare minima. Questi risultati suggeriscono che la via principale per generare nuove cellule nel miocardio con questo metodo è attraverso la riprogrammazione dei fibroblasti direttamente ai cardiomiociti.
“Questi sono risultati sorprendenti che mostrano che i fibroblasti possono essere riprogrammati direttamente in cardiomiociti. I nostri risultati dimostrano l’eccitante potenziale della riprogrammazione diretta come strategia per la rigenerazione cardiaca dopo infarto miocardico”, ha concluso il professor Ieda.