Un team di scienziati dell’Istituto di ricerca sul cancro di Londra, ha rivelato, in un recente studio, che una mutazione genetica fa in modo che le cellule tumorali siano in grado di tollerare un numero anomalo di cromosomi, una condizione che normalmente uccide le cellule, consentendo loro di adattarsi al loro ambiente e continuare a crescere.
I risultati della ricerca sono stati pubblicati sulla rivista scientifica Nature Communications.
Cellule tumorali: ecco come agisce la nuova mutazione genetica
Le cellule umane di solito hanno 46 cromosomi (23 paia). Se ne hanno più o meno, il fenomeno è denominato aneuploidia, ad è probabile che muoiano o crescano molto lentamente. Tuttavia, l’aneuploidia è molto comune nei tumori in crescita.
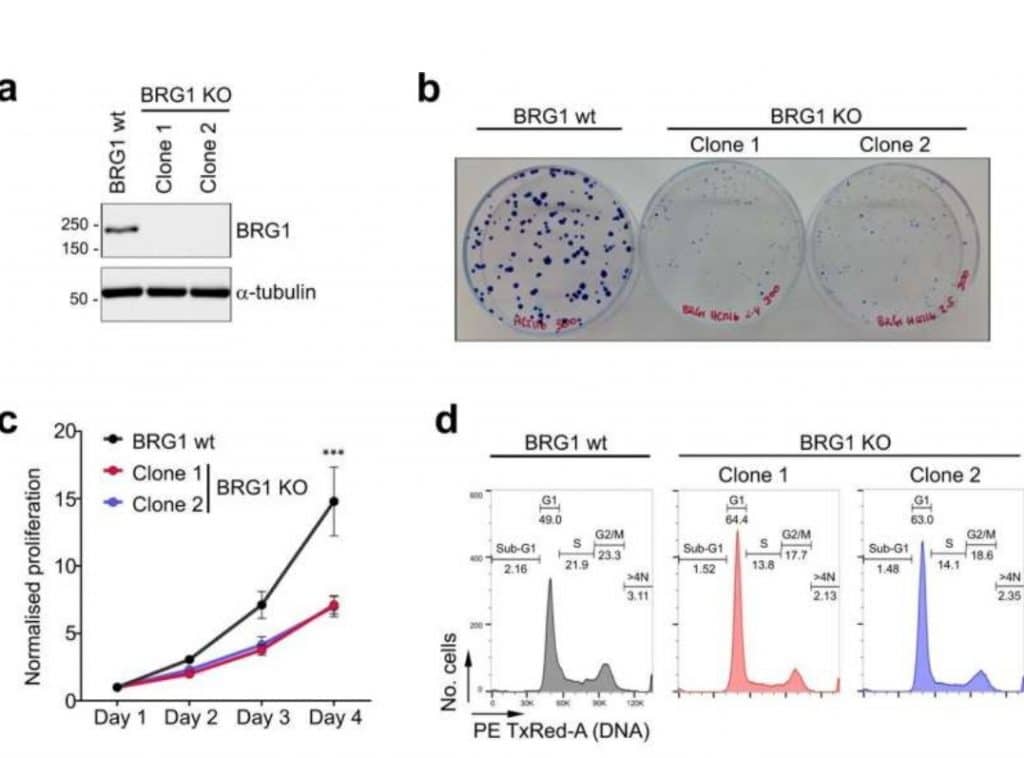
La nuova ricerca ha dimostrato che quando hanno disattivato il gene per una proteina chiamata BRG1, le cellule tumorali sono state in grado di acquisire cromosomi extra senza nessuno dei risultati negativi normalmente osservati nelle cellule aneuploidi.
I ricercatori hanno dichiarato che questo nuovo studio sulle cellule tumorali in laboratorio fornisce informazioni sul motivo per cui così tante cellule tumorali sono aneuploidi e tuttavia sono ancora in grado di subire una crescita eccessiva. Il loro obiettivo è che questi risultati si aggiungano ad una comprensione di come i tumori sono in grado di evolversi rapidamente in nuovi ambienti.
La scienza della scoperta, come questo studio, è vitale per la ricerca poiché aumenta la comprensione fondamentale della biologia del cancro. Senza risultati che spieghino quello che sta accadendo all’interno dei tumori, sarebbe impossibile sapere da dove cominciare quando si cercano nuovi farmaci che potrebbero essere efficaci contro le patologie tumorali.
Gli scienziati hanno studiato molto attentamente cosa è successo quando hanno disattivato il gene per BRG1 nelle cellule tumorali: i ricercatori hanno scoperto che all’inizio le cellule si replicavano molto lentamente, ma successivamente si riprendevano gradualmente nel giro di otto mesi.
Questa costante ripresa è stata associata al fatto che molte delle cellule diventavano aneuploidi, qualcosa che non si vedeva nelle cellule di controllo in cui era attivo il gene BRG1. Questi risultati suggeriscono che la perdita di BRG1 consente l’evoluzione dell’aneuploidia nelle cellule tumorali.
Essere aneuploidi può essere vantaggioso per le cellule tumorali in quanto fornisce una maggiore variazione genetica e copie aggiuntive di geni che consentono loro di evolversi e adattarsi a nuovi ambienti. Comprendere e affrontare la capacità del cancro di adattarsi ed evolversi è un’area chiave della ricerca presso l’ICR e costituisce una parte centrale dell’attuale strategia di ricerca dell’ICR.
Essere aneuploidi può essere vantaggioso per le cellule tumorali in quanto fornisce una maggiore variazione genetica e copie aggiuntive di geni che consentono loro di evolversi e adattarsi a nuovi ambienti. Comprendere e affrontare la capacità del cancro di adattarsi ed evolversi è un’area chiave della ricerca presso l’ICR e costituisce una parte centrale dell’attuale strategia di ricerca dell’ICR.
Questa ricerca evidenzia anche il ruolo di un complesso proteico chiamato SWI/SNF, un gruppo di proteine che lavorano insieme per avvolgere e svolgere il DNA in modo che possa essere copiato o riparato.
Uno su cinque di tutti i tumori che colpiscono l’essere umano contiene una mutazione che provoca una perdita di funzione del complesso SWI/SNF, suggerendo che SWI/SNF funziona come un oncosoppressore. Tuttavia, siamo lontani dal comprendere appieno il ruolo di SWI/SNF nel cancro.
BRG1, la proteina disattivata in questo studio, costituisce una parte fondamentale del complesso SWI/SNF. Poiché le cellule tumorali con aneuploidia possono esistere felicemente quando hanno perso BRG1, questa ricerca suggerisce che SWI/SNF ha un ruolo da svolgere nella prevenzione della tolleranza dell’aneuploidia.
Gli studiosi hanno inoltre visto che i percorsi biologici legati alla tolleranza all’aneuploidia sono cambiati immediatamente quando BRG1 è stato perso. Gli scienziati suggeriscono che questi primi cambiamenti nei percorsi di tolleranza all’aneuploidia consentono alle cellule senza BRG1 di avere un numero diverso di cromosomi senza la consueta perdita di salute osservata nelle cellule aneuploidi.
Gli scienziati hanno ulteriormente testato il ruolo di BRG1 nella tolleranza all’aneuploidia inducendo aneuploidia nelle cellule tumorali che avevano BRG1 disattivato e nelle cellule di controllo con BRG1 attivo, e hanno scoperto che il numero di cellule senza BRG1 sopravvissute dopo sette giorni di esposizione a un farmaco che causa aneuploidia era circa il doppio del numero di cellule con BRG1 sopravvissute. Ciò fornisce ulteriore supporto all’idea che le cellule senza BRG1 tollerano meglio l’aneuploidia rispetto a quelle con la proteina.
La professoressa Jessica Downs, Professoressa di epigenetica e stabilità del genoma presso l’ICR, capo dello studio, ha dichiarato: “La nostra ricerca ha contribuito a scoprire un fattore che potrebbe spiegare quante cellule tumorali sono in grado di esistere e crescere felicemente con un numero anormale di cromosomi quando questo stato normalmente si traduce in una diminuzione della forma fisica cellulare. In futuro questi risultati potrebbero fornire indizi su come la crescita del cancro potrebbe essere interrotta”.
“Il lavoro che facciamo per comprendere la biologia di base e l’evoluzione dei tumori è cruciale nella nostra lotta contro questa malattia“, ha continuato la scienziata.
Primo autore congiunto dello studio, il Dr. Pedro Zuazua-Villar, Senior Scientific Officer nell’Epigenetics and Genome Stability Team presso l’ICR, ha dichiarato: “Il cancro è così difficile da trattare perché è estremamente complesso e può adattarsi ai cambiamenti nella sua Questo studio rileva che essere tolleranti all’aneuploidia è un modo in cui le cellule tumorali sono in grado di adattarsi ed evolversi in modo così efficace”.
“Attraverso studi come questo speriamo di essere in grado di prevedere il percorso dell’evoluzione del cancro da un singolo campione di tumore, in modo che i medici possano vedere e contrastare la prossima mossa del cancro“, ha concluso lo studioso.