Una caratteristica centrale del diabete di tipo 1 è la perdita delle cellule beta del pancreas che producono insulina. Una squadra di ricercatori capitanata da Paolo Fiorina, MD, Ph.D., del Boston Children’s Hospital e Francesca D’Addio, MD, dell’Università di Milano ha identificato un percorso cellulare dannoso che causa la morte di queste cellule: nel momento in cui questo percorso è stato bloccato nei topi in campioni di tessuto umani, dove appunto risiedono le cellule beta del pancreas, hanno preservato le cellule beta, aumentato la produzione di insulina e prevenuto o ritardato l’insorgenza del diabete.
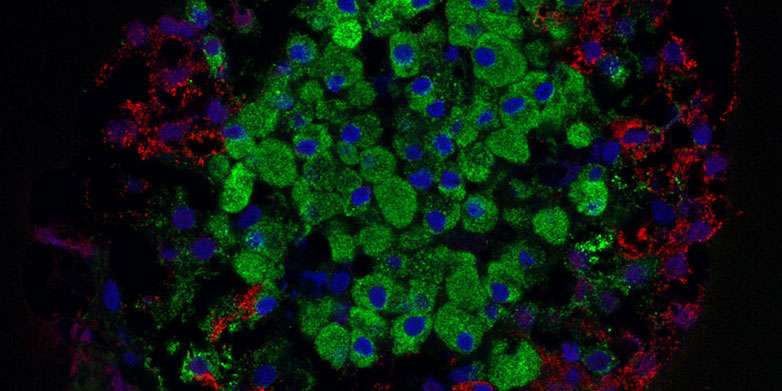
I risultati della ricerca sono stati pubblicati sulla rivista scientifica Nature Communications.
Cellule beta del pancreas: ecco come preservarle e ritardare o prevenire l’insorgenza del diabete
Le cellule beta del pancreas sintetizzano, immagazzinano e rilasciano insulina in modo univoco. Tratti molecolari, funzionali e ultrastrutturali specifici caratterizzano le loro proprietà di secrezione di insulina e il fentotipo di sopravvivenza.
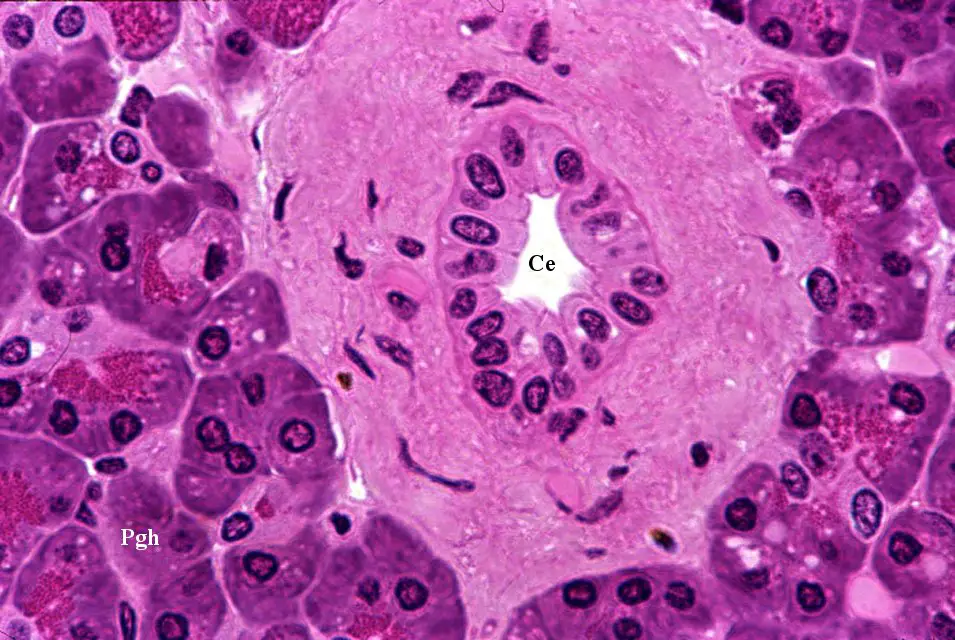
Si tratta cellule endocrine che sintetizzano, immagazzinano e rilasciano insulina, l’ormone anti-iperglicemico che antagonizza il glucagone, l’ormone della crescita, i glucocorticosteroidi, l’adrenalina e altri ormoni iperglicemici, per mantenere le concentrazioni di glucosio circolante all’interno di un ristretto intervallo fisiologico.
Le cellule beta hanno un diametro medio di 10 μm, contengono circa 20 pg di insulina per cellula e sono il tipo cellulare predominante nelle isole pancreatiche (50–80% di tutte le cellule endocrine delle isole).
Nel pancreas umano è stato riportato che la massa delle cellule beta varia da 0,6 a 2,1 g e la quantità di insulina nella ghiandola varia da 50 a 250 ug/g. In un essere umano adulto, le cellule beta rilasciano circa 30-70 U di insulina al giorno (principalmente a seconda del peso corporeo), metà della quale viene secreta dopo i pasti e il resto in condizioni basali.
Il rilascio di questo ormone è regolato da una complessa rete di molti diversi segnali di attivazione, potenziamento o inibizione, che consente la fornitura dell’ormone in quantità, cinetica e adattabilità per soddisfare le esigenze variabili minuto per minuto del corpo.
Durante lo studio, la squadra di scienziati si è servita di tre diversi modelli murini con diabete e ha riscontrato effetti protettivi indipendentemente dal fatto che il percorso fosse bloccato geneticamente o da un anticorpo. Gli studi su cellule umane e persone con diabete erano coerenti con i risultati dei topi. I ricercatori sperano di sviluppare una terapia per bloccare il percorso per il trattamento del diabete di tipo 1.
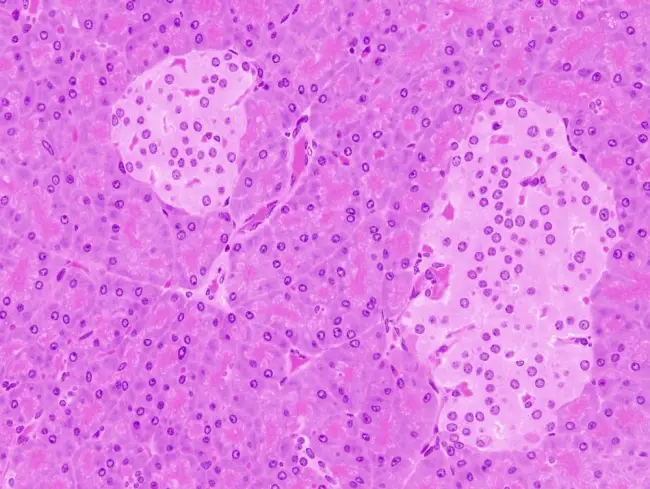
Il percorso, hanno mostrato, consiste in un ” Recettore della morte” sulle cellule beta del pancreas produttrici di insulina chiamato TMEM219, accoppiato con la proteina legante il fattore di crescita insulino-simile 3 (IGFBP3), che interagisce con questo recettore. Quando IGFBP3 si lega a TMEM219, i ricercatori hanno scoperto che le cellule beta muoiono attraverso il processo di apoptosi.
“Riteniamo che questo potrebbe essere un meccanismo naturale per tenere sotto controllo la popolazione di cellule beta“, ha affermato Fiorina: “Pensiamo che nella malattia, la produzione di IGFBP3 possa essere aumentata, quindi c’è una perdita di cellule beta”.
A sostegno di questa idea, il team ha studiato diversi gruppi di persone con diabete e ha riscontrato livelli aumentati di IGFBP3 che circolano nel sangue rispetto ai non diabetici. I livelli sono stati aumentati anche nelle persone a rischio di sviluppare il diabete e nei topi diabetici e prediabetici.
Nei topi, i ricercatori hanno utilizzato diversi mezzi per bloccare il percorso IGFBP3/TMEM219: bloccare IGFBP3, eliminare il gene del recettore TMEM219 o utilizzare una proteina ricombinante basata su parte di TMEM219. Ciascun approccio ha preservato le cellule beta del pancreas, aumentato la produzione di insulina e ritardato o prevenuto il diabete. Quando il team ha bloccato il percorso per un periodo di tempo più lungo, le popolazioni di cellule beta si sono espanse.
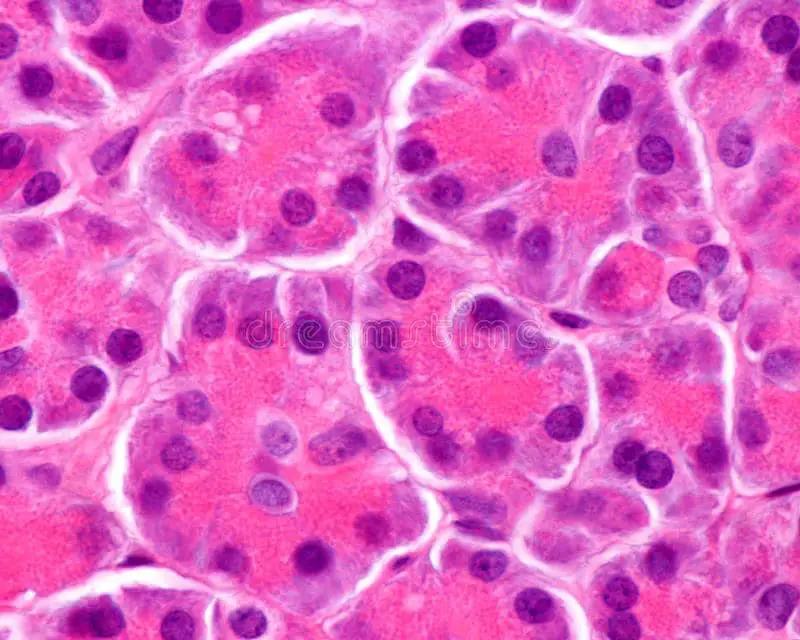
Fiorina e colleghi hanno anche studiato le isole pancreatiche umane, in cui risiedono le cellule beta. Quando hanno esposto le cellule all’IGFBP3, hanno avuto un più alto tasso di morte per apoptosi. Quando hanno bloccato il percorso IGFBP3/TMEM219, le cellule beta sono state protette e hanno continuato a produrre insulina.
“Il pensiero comune per il diabete di tipo 1 è che sia autoimmune“, ha spiegato Fiorina: “Ma l’immunoterapia non cura completamente il diabete. Pensiamo che anche la disregolazione dell’omeostasi delle cellule beta abbia un ruolo e che l’IGFBP3 agisca come una ‘betatossina’“.
Fiorina ha fondato una società di biotecnologie in Italia chiamataEnthera nel 2016 che sta sviluppando prodotti biologici basati su queste scoperte. I primi test sull’uomo di un trattamento con anticorpi per bloccare il percorso IGFBP3/TMEM219 potrebbero iniziare già a settembre 2022 in Europa.