C’è una sorprendente carenza di ricerche su come le cellule del cancro al seno possano rimanere dormienti, diffondersi e poi riemergere anni o addirittura decenni dopo, secondo una nuova revisione degli studi in vitro sul cancro al seno condotta da ricercatori dell’Università del Massachusetts Amherst.
La revisione è stata pubblicata su Science Advances.
Il nuovo studio sul cancro al seno
“La nostra analisi ha rilevato che meno dell’1% di tutti questi studi che combinano cellule con ambienti progettati esaminano la dormienza”, afferma Shelly Peyton, professoressa di ingegneria chimica. “Non è abbastanza. Semplicemente non capiamo cosa sta succedendo e questo sta uccidendo i pazienti.”
La dormienza del cancro al seno è un fenomeno in cui le cellule del cancro al seno metastatizzano o si diffondono in diversi siti di tessuti in tutto il corpo (tipicamente fegato, polmoni, cervello o ossa) ma non crescono.
“Non sono tumori rilevabili o sintomatici”, spiega Peyton. “A un paziente verrà rimosso il tumore primario e sembrerà libero dalla malattia per mesi, anni, persino decenni. E per ragioni che non comprendiamo, qualcosa cambia nell’ambiente che fa sì che quelle cellule inizino a ricrescere, e quindi si ha una metastasi mortale.”
I pazienti con cancro al seno metastatico hanno un tasso di sopravvivenza a cinque anni del 30%, rispetto a un tasso di sopravvivenza del 99% per il cancro al seno localizzato. “La diagnosi precoce del cancro al seno è fondamentale, soprattutto nel mondo occidentale”, afferma Peyton. “Si possono sottoporre a lumpectomie, radiazioni, piccoli interventi chirurgici. E le donne possono sopravvivere. È quando il cancro si diffonde che diventa molto più difficile da curare.”
Questa recidiva in organi distanti colpisce il 40% dei pazienti con cancro al seno in stadio iniziale e la dormienza del cancro al seno è un fattore che contribuisce. Ma mentre le metastasi hanno biomarcatori conosciuti, le cellule tumorali dormienti sono molto difficili da identificare.
“Quando hai una singola cellula di cancro al seno dormiente che si nasconde in un tessuto distante, è davvero difficile rilevarla”, afferma Nate Richbourg, autore principale dell’articolo e ricercatore post-dottorato presso il Peyton Lab. “E non vuoi fare una biopsia invasiva o prescrivere chemioterapia tossica per qualcosa che potrebbe non essere un problema.”
Tenendo presenti queste sfide, lo studio mirava a identificare le lacune nella ricerca sul cancro al seno, concentrandosi in particolare sugli studi in vitro o sulla ricerca che utilizza ambienti modello da banco invece di modelli animali o umani. Gli studi in vitro consentono il controllo preciso dell’ambiente, che secondo il gruppo di ricerca di Peyton può svolgere un ruolo decisivo nel decidere se una cellula rimane dormiente o si riattiva in un tumore metastatico mortale.
“Cosa possiamo controllare in questi ambienti artificiali che ci forniranno informazioni su come avviene la dormienza del cancro al seno e cosa possiamo fare anche per curarlo?” si chiede Richbourg, descrivendo l’importanza della modellazione in vitro. “Quando creiamo questa dormienza artificiale, possiamo vedere quante di quelle cellule potrebbero trasformarsi nuovamente in cellule proliferanti e potenzialmente mortali del cancro al seno.”
La loro analisi evidenzia quanto sia complesso il ruolo dell’ambiente. “Se hai una cellula [di cancro al seno] da qualche parte nel midollo osseo , avrai altre cellule lì, i fattori fisici nel tuo ambiente e i fattori biochimici”, fornisce Richbourg come esempio.
“Cerchiamo di utilizzare modelli riduttivi per separare ciò che influenza questo comportamento. Ma quello che stiamo vedendo è che tutto funziona insieme per creare questo effetto di dormienza del cancro al seno. Quanto meglio riusciamo a creare modelli che catturino tutte quelle sfumature, tanto meglio riusciremo a capirlo.”
Per Peyton, il loro lavoro è anche un invito all’azione. “Il documento chiede al settore di fare di più”, afferma. Ciò include essere più creativi con i materiali già esistenti e sviluppare nuovi materiali; identificare modi per modellare la progressione decennale della dormienza che è impossibile ricreare in un singolo studio; e ampliando la diversità delle linee cellulari utilizzate per la ricerca (Richbourg sottolinea che molti degli studi esaminati utilizzavano la stessa linea cellulare, MDA-MB-231, derivata da una donna bianca di età compresa tra 40 e 50 anni).
Infine, i ricercatori puntano all’obiettivo finale: trattamenti migliori per salvare i pazienti. “Vediamo che ci sono alcuni studi clinici in corso derivati da alcuni di questi modelli in vitro”, afferma Ninette Irakoze, studentessa laureata al Peyton Lab. “Il documento dà speranza che, con un maggiore sviluppo di questi modelli in vitro, alla fine potremmo trovare trattamenti per sradicare il cancro dormiente”.
La recidiva del cancro al seno può essere innescata da danni chemioterapici alle cellule non tumorali
Un farmaco chemioterapico standard danneggia le cellule non tumorali circostanti, che possono poi risvegliare le cellule tumorali dormienti e promuovere la crescita del cancro, secondo uno studio pubblicato sulla rivista ad accesso aperto PLoS Biology da Ramya Ganesan della Emory University, Stati Uniti, e colleghi. La scoperta è importante per comprendere la recidiva del cancro e potrebbe indicare nuovi importanti obiettivi per prevenirla.
I progressi nel trattamento del cancro , compresa la chemioterapia, hanno ridotto drasticamente la mortalità per molti tipi di cancro, compreso il cancro al seno . Tuttavia, fino al 23% delle pazienti affette da cancro al seno presenta una recidiva entro i primi cinque anni. Il trattamento ha lo scopo di uccidere tutte le cellule tumorali , ma spesso alcune cellule entrano in uno stato di dormienza, in cui smettono di dividersi e diventano insensibili agli agenti chemioterapici. La recidiva si verifica quando le cellule dormienti si risvegliano e ricominciano a dividersi.
Alcuni studi hanno indicato che la chemioterapia stessa può favorire la fuga dalla dormienza, ma il meccanismo di questo effetto non è stato chiaro.
Per esplorare questa domanda, gli autori hanno lavorato sia con un modello cellulare che con un modello murino di cancro al seno. È importante sottolineare che il modello cellulare conteneva sia cellule tumorali che cellule stromali non tumorali, cellule del tessuto connettivo che si trovano nel seno e in altri tessuti.
Hanno somministrato il farmaco chemioterapico docetaxel a concentrazioni fisiologicamente rilevanti e hanno scoperto che anche a dosi molto basse, le cellule stromali venivano danneggiate, mentre le cellule tumorali no, e che il trattamento induceva il rientro nel ciclo cellulare nelle cellule tumorali.
Il motore di questo risveglio delle cellule dormienti, hanno dimostrato gli autori, è stato il rilascio di due molecole chiave di segnalazione cellulare, il fattore stimolante le colonie di granulociti (G-CSF) e l’interleuchina-6 (IL-6) da parte delle cellule stromali danneggiate , che agivano sulle cellule stromali danneggiate. cellule dormienti per favorirne la crescita, sia in vitro che in vivo.
Ciò ha fornito al team potenziali bersagli anticancro e ha dimostrato che gli anticorpi che neutralizzavano il G-CSF o l’IL-6, o un farmaco che bloccava il mediatore di tali segnali all’interno delle cellule tumorali, inibivano il risveglio dalla dormienza dovuto al trattamento con docetaxel.
Questi risultati hanno diverse importanti implicazioni. In primo luogo, evidenziano l’importanza delle cellule circostanti, non solo delle cellule tumorali stesse, nel determinare la risposta alla chemioterapia.
In secondo luogo, forniscono un possibile fondamento meccanicistico per l’osservazione che alti livelli sierici di IL-6 sono associati a recidiva precoce nei pazienti con cancro al seno sottoposti a chemioterapia, rafforzando potenzialmente l’utilità di quel biomarcatore nella pianificazione del trattamento. In terzo luogo, forniscono nuovi obiettivi per prevenire le recidive.
Il Dr. Ganesan e il Dr. Sukhatme aggiungono: “Il nostro articolo evidenzia un effetto deleterio della chemioterapia antitumorale: il rilascio di IL-6 stromale e G-CSF da parte della chemioterapia con taxani ha risvegliato cellule di cancro al seno dormienti, un meccanismo postulato per la recidiva del tumore.
Blocco transitorio delle citochine la segnalazione durante la somministrazione della chemioterapia può prevenire la recidiva del tumore.”
Come si diffonde il cancro ad altre parti del corpo?
Tutti i tumori iniziano in un singolo organo o tessuto, come i polmoni o la pelle. Quando questi tumori sono confinati nel loro organo o tessuto originale, sono generalmente più curabili.Ma un cancro che si diffonde è molto più pericoloso, poiché gli organi a cui si diffonde possono essere organi vitali. Un cancro della pelle , ad esempio, potrebbe diffondersi al cervello.
Questa nuova crescita rende il cancro molto più difficile da trattare, poiché può essere difficile trovare tutti i nuovi tumori. Se un cancro riesce a invadere diversi organi o tessuti, può diventare rapidamente letale.
Quando il cancro si diffonde in questo modo, si chiama metastasi . Le metastasi sono responsabili della maggior parte (67%) delle morti per cancro.
I nostri corpi sono costituiti da trilioni di minuscole cellule. Per mantenerci in salute, il nostro corpo sostituisce costantemente le cellule vecchie o danneggiate.
Ogni cellula ha un lavoro specifico e una serie di istruzioni (DNA) che le dicono cosa fare. Tuttavia, a volte il DNA può danneggiarsi.
Questo danno potrebbe modificare le istruzioni. Una cellula potrebbe ora moltiplicarsi in modo incontrollabile o perdere una proprietà nota come aderenza. Questo si riferisce a quanto è appiccicosa una cellula e quanto bene può aderire alle altre cellule circostanti e rimanere dove dovrebbe essere.
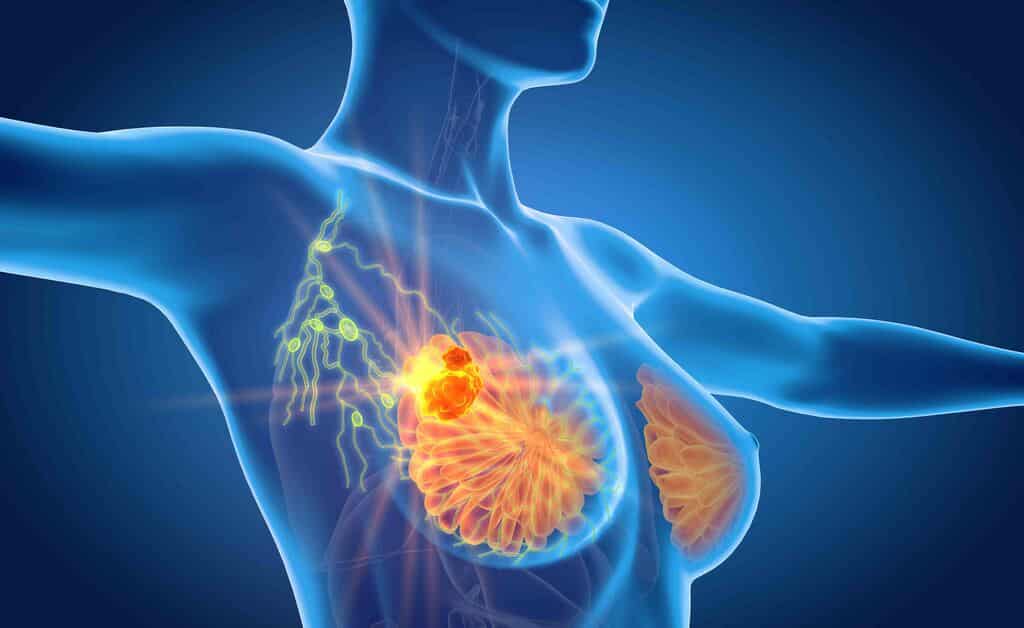
Se una cellula tumorale perde la sua aderenza, può staccarsi dal tumore originale e viaggiare attraverso il flusso sanguigno o il sistema linfatico quasi ovunque. Ecco come avvengono le metastasi.
Molte di queste cellule tumorali viaggianti moriranno, ma alcune si stabiliranno in una nuova posizione e inizieranno a formare nuovi tumori.
Particolari tumori hanno maggiori probabilità di metastatizzare a particolari organi che aiutano a sostenerne la crescita. I tumori al seno comunemente metastatizzano alle ossa, al fegato e ai polmoni, mentre i tumori della pelle come i melanomi hanno maggiori probabilità di finire nel cervello e nel cuore.
A differenza dei tumori che si formano in organi o tessuti solidi, i tumori del sangue come la leucemia si muovono già liberamente attraverso il flusso sanguigno, ma possono sfuggire e stabilirsi in altri organi come il fegato o il cervello.
Più a lungo un cancro cresce, maggiore è la probabilità che metastatizzi. Se non viene diagnosticato precocemente, il cancro di un paziente potrebbe metastatizzare anche prima della diagnosi iniziale.
Le metastasi possono verificarsi anche dopo il trattamento del cancro . Ciò accade quando le cellule tumorali sono dormienti durante il trattamento: i farmaci potrebbero non “vedere” quelle cellule. Queste cellule invisibili possono rimanere nascoste nel corpo, solo per svegliarsi e iniziare a trasformarsi in un nuovo cancro mesi o addirittura anni dopo.
Per i pazienti che hanno già metastasi tumorali al momento della diagnosi, è importante identificare la posizione del tumore originale, chiamato “sito primario”.
Un cancro che ha avuto origine nel seno ma si è diffuso al fegato probabilmente si comporterà ancora come un cancro al seno e quindi risponderà meglio a una terapia anti-cancro al seno e non a una terapia anti-cancro al fegato.
Poiché a volte le metastasi possono crescere più velocemente del tumore originale, non è sempre facile dire quale tumore sia comparso per primo. Questi tumori sono chiamati “tumori di origine sconosciuta” e sono l’ undicesimo tumore più comunemente diagnosticato in Australia .
Un modo per migliorare il trattamento del cancro metastatico è migliorare le nostre modalità di rilevamento e identificazione dei tumori, per garantire che i pazienti ricevano i farmaci più efficaci per il loro tipo di cancro.
Se non trattata, la maggior parte dei tumori prima o poi acquisirà la capacità di metastatizzare.
Sebbene attualmente non esistano interventi che prevengano specificamente le metastasi, ai pazienti affetti da cancro a cui è stato rimosso chirurgicamente il tumore può essere somministrata anche la chemioterapia (o altri farmaci) per cercare di eliminare eventuali cellule tumorali nascoste ancora in circolazione.
Il modo migliore per prevenire le metastasi è diagnosticare e trattare precocemente i tumori. Le iniziative di screening del cancro come i programmi di screening del cancro cervicale , intestinale e mammario in Australia sono modi eccellenti per rilevare precocemente i tumori e ridurre le possibilità di metastasi.
Nuovi programmi di screening per individuare precocemente i tumori sono in fase di ricerca per molti tipi di cancro. Alcuni di questi sono semplici: scansioni TC del corpo per cercare eventuali tumori, come nel nuovo programma di screening del cancro al polmone in Inghilterra.
È anche possibile utilizzare l’intelligenza artificiale (AI) per esaminare le scansioni dei pazienti, che potrebbero identificare nuovi modelli che suggeriscono la presenza di un cancro e migliorare il rilevamento del cancro da questi programmi.
Sono in fase di sviluppo anche metodi di screening più avanzati. Il programma Cancer Moonshot del governo degli Stati Uniti sta attualmente finanziando la ricerca sugli esami del sangue in grado di rilevare molti tipi di cancro nelle fasi iniziali.
Un giorno potrebbe anche esserci un test di tipo RAT per il cancro, come esiste per il COVID.
Comprendere come si verificano le metastasi ci consente di trovare nuovi modi per prevenirle. Un’idea è quella di prendere di mira le cellule tumorali dormienti e impedire loro di risvegliarsi.
La prevenzione diretta delle metastasi con i farmaci non è ancora possibile. Ma c’è la speranza che, man mano che gli sforzi di ricerca continuano a migliorare le terapie antitumorali, diventino anche più efficaci nel trattamento dei tumori metastatici.
Per ora, la diagnosi precoce è il modo migliore per garantire che un paziente possa sconfiggere il cancro.