I ricercatori della University of California San Diego School of Medicine hanno scoperto un percorso molecolare fondamentale per l’inizio del cancro al pancreas. Il meccanismo potrebbe anche contribuire all’elevata resistenza della malattia alla chemioterapia e alla sua propensione alle metastasi.
I risultati dello studio sono stati pubblicati sulla rivista scientifica Nature Cell Biology.
Cancro al pancreas correlati alla resistenza delle cellule: ecco cosa dice la ricerca
Il recente studio ha scoperto che le cellule che danno inizio al cancro al pancreas devono prima superare lo “stress da isolamento” locale creando il proprio microambiente che promuove il tumore, quindi reclutare le cellule circostanti in questa rete. Mirando a questo percorso di inizio del tumore, nuove terapie potrebbero limitare la progressione, la ricaduta e la diffusione del carcinoma pancreatico.
Il cancro al pancreas è uno dei tumori più letali, notoriamente resistente al trattamento. Quasi tutti i pazienti presentano recidiva o metastasi del cancro.
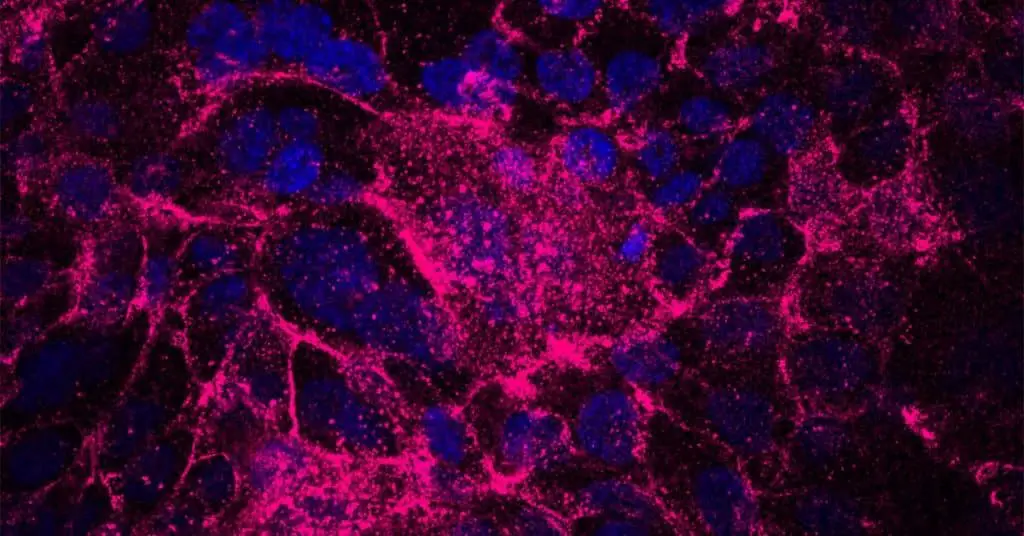
Nelle prime fasi della formazione del cancro al pancreas, le cellule tumorali (quelle con mutazioni cancerose, chiamate oncogeni) subiscono una perdita di adesione ad altre cellule e alla matrice extracellulare , la rete di macromolecole che racchiude e sostiene tutte le cellule. Questo isolamento porta a una mancanza locale di ossigeno e sostanze nutritive. La maggior parte delle cellule non sopravvive a tale stress da isolamento, ma un certo gruppo di cellule sì.
Le cellule chedanno il via alla genesi del cancro al pancreas svolgono un ruolo importante nella formazione, nella recidiva e nella diffusione metastatica dei tumori. Ciò che le distingue dalle altre cellule tumorali è la loro resilienza a queste prime condizioni scadenti. Come i cactus in un deserto, possono adattarsi all’ambiente ostile e preparare il terreno per un’ulteriore progressione del tumore.
“Il nostro obiettivo era capire quali proprietà speciali hanno queste cellule che danno inizio al tumore e se possiamo controllare la crescita e la diffusione del cancro interrompendole”, ha affermato l’autore senior dello studio David Cheresh, Ph.D., Distinguished Professor e vicepresidente del Dipartimento di Patologia presso la UC San Diego School of Medicine e membro del UC San Diego Moores Cancer Center.
Per rispondere a queste domande, il primo autore Chengsheng Wu, Ph.D., un borsista postdottorato nel laboratorio di Cheresh, ha sottoposto le linee cellulari pancreatiche a varie forme di stress, tra cui bassi livelli di ossigeno e zucchero. Ha quindi identificato quali cellule potrebbero adattarsi alle condizioni difficili e ha osservato quali geni e molecole sono stati modificati in queste cellule.
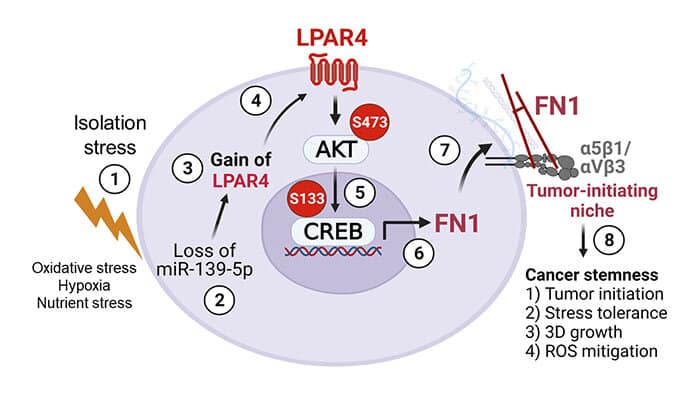
Le cellule che iniziano il tumore tolleranti allo stress hanno mostrato livelli ridotti di un microRNA soppressore del tumore, miR-139-5p. Ciò a sua volta ha portato alla sovraregolazione del recettore 4 dell’acido lisofosfatidico (LPAR4), un recettore accoppiato a proteine G sulla superficie cellulare.
“LPAR4 non si trova normalmente sulle cellule felici, ma viene attivato in ambienti stressanti per aiutare le cellule a sopravvivere, il che è particolarmente vantaggioso per le cellule che iniziano il tumore”, ha affermato Cheresh.
I ricercatori hanno scoperto che l’espressione di LPAR4 ha promosso la produzione di nuove proteine della matrice extracellulare, consentendo alle cellule tumorali solitarie di iniziare a costruire il proprio microambiente che supporta il cancro al pancreas.
La nuova matrice extracellulare era particolarmente ricca di fibronectina, una proteina che si lega ai recettori transmembrana chiamati integrine sulle cellule circostanti. Una volta che le integrine su queste cellule hanno percepito la fibronectina, hanno iniziato a segnalare alle cellule di esprimere i propri geni che danno inizio al cancro al pancreas. Alla fine, queste altre cellule sono state reclutate nella matrice di fibronectina depositata dalle cellule che danno inizio al tumore e ha iniziato a formarsi un tumore.
Lo stress da isolamento tuttavia non è l’unico modo in cui questo percorso di segnalazione può essere attivato, hanno affermato i ricercatori. I farmaci chemioterapici sono progettati anche per mettere sotto stress le cellule tumorali. In effetti, il team di Cheresh ha scoperto che anche il trattamento di cellule tumorali in coltura e cancro al pancreas nei topi con chemioterapici standard ha portato alla sovraregolazione di LPAR4. I ricercatori hanno detto che questo potrebbe spiegare come tali cellule tumorali potrebbero sviluppare una tolleranza allo stress e resistenza ai farmaci.
Ulteriori esperimenti hanno anche dimostrato che l’uso di antagonisti dell’integrina per bloccare la capacità delle cellule di utilizzare la matrice della fibronectina ha invertito il beneficio della tolleranza allo stress dell’espressione di LPAR4. Pertanto, gli autori suggeriscono che il targeting del percorso LPAR4 o l’interruzione dell’interazione fibronectina/integrina potrebbe essere efficace nel prevenire la crescita, la diffusione e la resistenza ai farmaci del cancro al pancreas.
“I nostri risultati stabiliscono un ruolo fondamentale per LPAR4 nell’iniziazione del tumore pancreatico e un probabile ruolo in altri tumori epiteliali, come il cancro ai polmoni”, ha affermato Cheresh. “È fondamentale per la capacità delle cellule che danno inizio al tumore di superare lo stress da isolamento e costruire la propria nicchia in cui possono formarsi i tumori”.
Lo stress da isolamento tuttavia non è l’unico modo in cui questo percorso di segnalazione può essere attivato, hanno affermato i ricercatori. I farmaci chemioterapici sono progettati anche per mettere sotto stress le cellule tumorali. In effetti, il team di Cheresh ha scoperto che anche il trattamento di cellule tumorali in coltura e tumori pancreatici nei topi con chemioterapici standard ha portato alla sovraregolazione di LPAR4. I ricercatori hanno detto che questo potrebbe spiegare come tali cellule tumorali potrebbero sviluppare una tolleranza allo stress e resistenza ai farmaci.
Ulteriori esperimenti hanno anche dimostrato che l’uso di antagonisti dell’integrina per bloccare la capacità delle cellule di utilizzare la matrice della fibronectina ha invertito il beneficio della tolleranza allo stress dell’espressione di LPAR4. Pertanto, gli autori suggeriscono che il targeting del percorso LPAR4 o l’interruzione dell’interazione fibronectina/integrina potrebbe essere efficace nel prevenire la crescita, la diffusione e la resistenza ai farmaci del cancro al pancreas.
“Possiamo pensare alle cellule che danno inizio al tumore come in uno stato transitorio che può essere indotto da diversi fattori di stress, quindi il nostro obiettivo clinico sarebbe impedire alle cellule oncogeniche di entrare in questo stato”, ha affermato Cheresh. “Ora che abbiamo identificato il percorso, possiamo valutare tutti i diversi modi in cui possiamo intervenire”.
L’associazione del nuovo farmaco con i chemioterapici esistenti che mettono sotto stress le cellule tumorali mature potrebbe anche mitigare gli effetti della resistenza ai farmaci e rendere più efficaci i trattamenti contro il cancro, hanno affermato gli autori.
Il Dott. Massimiliano Tuveri, Dirigente Medico presso l’Unità di Chirurgia del Pancreas del Policlinico Borgo Roma di Verona, ha dichiarato: “L’aumento delle diagnosi di cancro al pancreas è piuttosto evidente. Diciamo che entro il 2030, come proiezione, il tumore del pancreas diventerà la seconda causa di morte per tumore dopo quello del polmone. Stiamo parlando di numeri impressionanti.
Le ipotesi sono diverse. Innanzitutto, si vive di più ed è chiaro che corriamo tutti il rischio di ammalarci per tumore, in senso lato vale per tutti i tipi. La fascia di età più colpita è quella dai 60 anni in su. Altre cause sono rappresentate dall’incremento ponderale (sovrappeso e obesità), il diabete mellito di tipo II, una storia di pancreatite cronica, in particolare le forme cosidette ereditarie. A questo concorrono sicuramente uno stile di vita non congruo: il fumo, l’abuso di alcolici, ambiente inquinato. Il pancreas per certi versi è molto sensibile agli stessi fattori di rischio del polmone.
L’alimentazione gioca un ruolo di primissimo piano ma molto poco conosciuto e quindi sottovalutato. Non si tratta infatti semplicemente del fatto che mangiamo cibi molto sofisticati e molto ricchi soprattutto di grassi, oltre al cosidetto “junk food”. E’ l’apporto calorico eccessivo che fa la vera differenza. Molti pazienti giungono alla nostra osservazione sovrappeso o con franca obesità.
Viene spesso sottovalutato, in quanto poco noto, il fatto che il processo digestivo sia uno dei processi più complessi che avvengano nel nostro l’organismo. Questo processo coinvolge e sollecita il sistema immunitario. Il sistema immunitario, per esemplificare, è come un esercito. Se noi impieghiamo in modo continuativo, cronico, parte di questo esercito nell’attività digestiva, sguarniamo altre attività di controllo. Sappiamo infatti da ampia letteratura che il paziente obeso è più predisposto a sviluppare tumori. Inoltre, i cibi molto calorici e sofisticati impongono un impegno digestivo e un surplus di attività da parte del pancreas.
Una regolare attività fisica e mangiare sano ed equilibrato con un giusto apporto calorico sono la condizione necessaria, non sufficiente, per mantenere l’organismo in forma. Devono cioè convergere tanti fattori anche se il ruolo principale è svolto dal proprio patrimonio di DNA.
Faccio un esempio pratico. Prendiamo ad esempio il fumo. Il pancreas è un organo caratterizzato da bassi flussi sanguigni, e la cellula pancreatica, è molto sensibile alla carenza di ossigeno. Se noi con il fumo cronicamente diminuiamo anche di poco la concentrazione di ossigeno in un organo come il pancreas determiniamo una sofferenza cronica per le cellule per cui un errore a livello genico può più facilmente verificarsi e mantenersi.
Fondamentalmente abbiamo una grossa differenza tra quelli che interessano la testa pancreatica e quelli che interessano il corpo e la coda. La diagnosi è sempre più tardiva nei tumori del corpo e della coda, perché nei tumori che interessano la testa abbiamo spesso la compressione del coledoco, un condotto che porta la bile dal fegato all’intestino allo scopo di completare il processo digestivo. Questo fa sì che il paziente non possa più secernere la bile a livello intestinale creando la condizione detta di ittero (il paziente assume un colorito tendente al giallo, in quanto la bilirubina viene riversata nel sangue).
Questo per quanto possa allarmare il paziente è spesso un segno importantissimo che ci permette di fare una diagnosi precoce. Questo non si verifica nei tumori del corpo o della coda per cui nel computo totale circa l’80% di questi tumori siano inoperabili al momento della diagnosi. Sono purtroppo i numeri crudi di questa malattia. Noi oggi operiamo poco più del 20% dei pazienti che arrivano alla nostra osservazione, gli altri non andranno mai al tavolo operatorio.
È stato visto purtroppo che i famosi “check-up”, che andavano molto di moda negli anni ’80 e ’90, non hanno assolutamente ridotto la mortalità per questo tipo di tumori. Io penso che comunque sia un’ecografia annuale dopo i 40 anni possa essere utile. Anche qui bisogna sottolineare che il pancreas è una ghiandola situata molto in profondità nella cavità addominale, quindi studiarla diventa veramente complesso.
Quindi occorre che chi fa l’ecografia sia molto esperto perché molto spesso la presenza dell’intestino che si sovrappone non permette di studiarla. L’inesperienza dell’operatore o pazienti con situazioni anatomiche non favorevoli (interposizione del colon o pazienti obesi) portano a risultati inconcludenti. Un’ecografia periodica potrebbe non diagnosticare in tempo un cancro al pancreas.
Io credo che sia sempre meglio, per tutti i tumori compreso il pancreas, lavorare sui fattori di rischio: fumo, alcol, alimentazione. Diciamo che per tutto il resto chiaramente la differenza la fa il DNA: se uno nasce con scarsa predisposizione può permettersi molte cose, mentre chi nasce con delle mutazioni genetiche che permettono lo sviluppo di un tumore percorre tutta un’altra strada.
Un possibile aiuto può venire dai marcatori tumorali, che tuttavia risultano non specifici per una singola forma di tumore. Rappresentano però un utile strumento da interpretare insieme agli altri esami diagnostici”.
Secondo l’Istituto Nazionale dei Tumori: ” Il tumore al pancreas rappresenta il 3% di tutti i nuovi casi di tumore ogni anno e, nel 2020 sono attese in Italia 14.000 nuove diagnosi. Il fumo di sigaretta è principale il fattore di rischio associato all’insorgenza del tumore al pancreas, con un rischio di 2-3 volte superiore nei fumatori rispetto ai non fumatori.
Tra gli altri fattori di rischio troviamo fattori dietetici ed abitudini di vita quali l’obesità, la ridotta attività fisica, l’alto consumo di grassi (in particolare i grassi saturi), l’alimentazione povera in verdura e frutta.
Ci sono condizioni preesistenti come la pancreatite cronica, che si associa ad un rischio fino a 10 volte più elevato rispetto alla popolazione generale, il diabete mellito con rischio fino a 1,5-2 volte maggiore, un precedente intervento chirurgico con asportazione dello stomaco (gastrectomia), che può moltiplicare il rischio fino a 3-5 volte. Inoltre il 10% dei Pazienti presenta una storia familiare di tumore al pancreas, questo indica la presenza di fattori genetici predisponenti (per esempio le mutazioni geniche di BRCA)” .