I nostri corpi ospitano innumerevoli batteri, e così anche i nostri tumori, si è scoperto. Negli ultimi 5 anni, i ricercatori hanno dimostrato che il tessuto tumorale contiene intere comunità di batteri e funghi.
Ora, sembra che alcuni dei batteri possano essere complici del cancro. In un articolo su Nature questa settimana, un team guidato da Susan Bullman del Fred Hutchinson Cancer Center riferisce che nei tumori orali e colorettali, i batteri vivono all’interno delle cellule tumorali e aumentano la loro produzione di proteine note per sopprimere le risposte immunitarie.
Gli intrusi microbici possono innescare una reazione a catena che impedisce al sistema immunitario di uccidere le cellule cancerose e possono anche aiutare il cancro a metastatizzare in altre parti del corpo.
Lo studio non conferma del tutto la tesi di un ruolo batterico nel cancro, ma è molto suggestivo, afferma Laurence Zitvogel, immunologo del tumore presso il Gustave Roussy Institute. “Dimostra che i batteri nei tumori colorettali e orali possono disturbare attivamente l’equilibrio immunitario”, afferma.
La conferma che i microbi possono causare la crescita o la diffusione dei tumori potrebbe aprire nuovi modi per rendere più efficace il trattamento del cancro, ad esempio uccidendo i batteri con antibiotici.
E poiché ogni tipo di cancro sembra avere un microbioma unico, i ricercatori stanno esplorando se i microbi potrebbero essere usati come strumento diagnostico per rilevare il cancro precocemente in un campione di sangue.
Fino a poco tempo fa, la maggior parte dei ricercatori sul cancro credeva che i tumori fossero sterili, dice Ravid Straussman, un ricercatore sul cancro presso il Weizmann Institute of Science.
Ma circa un decennio fa, come postdoc presso il Broad Institute, Straussman scoprì per caso che le cellule tumorali pancreatiche e colorettali umane cresciute in laboratorio smettevano di rispondere a un farmaco antitumorale chiamato gemcitabina quando i batteri Mycoplasma erano presenti nella coltura. I batteri, scoprì, “proteggevano” le cellule producendo un enzima che scompone la gemcitabina.
Straussman ha scoperto di poter rendere inefficace la gemcitabina nei topi con cancro al colon iniettando negli animali altri tipi di batteri, incluso un ceppo di Escherichia coli, e che il trattamento con antibiotici ha ripristinato l’efficacia del farmaco.
Quando ha studiato 113 campioni di cancro al pancreas umano, ha trovato batteri che producevano gli enzimi masticatori di farmaci nel 76% di essi, sollevando la questione se contribuissero alla resistenza ai farmaci nei tumori umani. Straussman ei suoi colleghi stanno ora pianificando una sperimentazione clinica per verificare se gli antibiotici possono migliorare il trattamento del cancro al pancreas.
Poco dopo, Gregory Sepich-Poore, uno studente di dottorato nel laboratorio del ricercatore sul microbioma Rob Knight presso l’Università della California, San Diego (UCSD), era alla ricerca di modi per diagnosticare precocemente i tumori del pancreas.
Era motivato dalla morte di sua nonna per cancro, che spesso viene diagnosticata troppo tardi perché il trattamento sia efficace. Ispirato dall’articolo di Straussman del 2017, Sepich-Poore ha iniziato a setacciare il Cancer Genome Atlas, un ampio database di DNA di tumori umani, alla ricerca di frammenti di materiale genetico da microbi.
Nel marzo 2020, lui, Knight e colleghi hanno riferito che l’RNA e il DNA microbici erano presenti in ciascuno dei 33 tipi di cancro che hanno studiato e che ogni tipo di cancro aveva un microbioma unico. Il team ha anche trovato quelle firme microbiche distinte nei campioni di sangue di pazienti affetti da cancro.
Sulla base delle loro scoperte, Sepich-Poore e Knight hanno co-fondato Micronoma, con sede a San Diego, una startup che mira a identificare il cancro allo stadio iniziale nei campioni di sangue, una cosiddetta biopsia liquida.
Batteri: interazioni
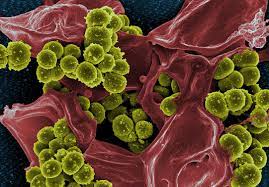
Più tardi, nel 2020, Straussman e i suoi colleghi hanno confermato che molti tumori hanno popolazioni distintive di microbi e hanno scoperto che risiedono principalmente all’interno del cancro e delle cellule immunitarie, piuttosto che tra quelle cellule.
I funghi spesso si insediano anche nei tumori. In uno studio su 17.000 tumori, pubblicato su Cell a settembre, i gruppi UCSD e Weizmann hanno trovato specie fungine che risiedono in ciascuno dei 35 tipi di cancro.
Ancora una volta, ogni tipo di cancro è stato associato a una distinta combinazione di specie, che potrebbe aiutare a perfezionare gli strumenti diagnostici di Micronoma. (Straussman ora siede nel comitato consultivo scientifico dell’azienda.)
Il documento riportava un’altra scoperta sorprendente: alcune combinazioni di specie fungine correlavano con minori probabilità di sopravvivenza in diversi tipi di cancro, più fortemente nel cancro alle ovaie e al seno.
A ottobre, un altro gruppo ha riportato qualcosa di simile in Cancer Cell: la presenza di una particolare firma batterica sembrava accelerare la morte nel cancro al pancreas. La probabilità di sopravvivere a 2 anni dal trattamento è raddoppiata nei pazienti che non avevano la firma.
“Questa è una scoperta che fa alzare le sopracciglia”, afferma il coautore Martin Blaser, ricercatore sul microbioma del cancro presso la Rutgers University, Piscataway, che fa anche parte del comitato consultivo scientifico di Micronoma.
Ma nessuno di questi risultati ha mostrato come funghi o batteri potrebbero portare a un risultato peggiore. Ora, Bullman ei suoi colleghi hanno affrontato la questione studiando otto tumori rimossi da pazienti con cancro orale e altri 19 da pazienti con cancro del colon-retto.
La mappatura della distribuzione dei microbi ha mostrato che colonizzavano solo aree specifiche dei tumori. Queste regioni infette avevano alti livelli di proteine note per sopprimere le cellule T che combattono il cancro o alimentare la crescita del cancro. Cellule T accumulate al di fuori di queste regioni, hanno scoperto i ricercatori, ma poche sono state trovate all’interno.
Invece, le regioni contenevano neutrofili, un tipo di cellula immunitaria che combatte le infezioni, tra le altre cose. “È concepibile che i batteri stiano in qualche modo causando l’allontanamento delle cellule T dal tumore”, afferma Blaser.
Usando una tecnica chiamata sequenziamento di cellule singole, i ricercatori hanno scoperto che i batteri infettano preferenzialmente le cellule epiteliali tumorali, che rivestono la superficie interna degli organi, e che solo le cellule in cui i batteri Fusobacterium e Treponema erano dominanti tendevano a mostrare caratteristiche sia immunosoppressive che promotrici del cancro.
“Questo documento colma una lacuna critica” mostrando che i batteri all’interno delle cellule tumorali possono alterare il comportamento delle cellule, afferma George Miller, medico oncologo e ricercatore presso il Trinity Health del New England.
Bullman e i suoi colleghi hanno anche co-coltivato specie di Fusobacterium con sferoidi del cancro del colon, piccoli modelli di tumori umani, incorporati in una matrice che conteneva neutrofili e li hanno confrontati con sferoidi privi di batteri.
Con i batteri presenti, i neutrofili tendevano a spostarsi verso le cellule tumorali, proprio come facevano nei campioni tumorali dei pazienti. E i ricercatori hanno visto cellule tumorali infette staccarsi dagli sferoidi e migrare, il che secondo Bullman potrebbe essere un segno che stanno metastatizzando.
Zitvogel afferma che il documento dipinge un quadro plausibile di come i microbi potrebbero ostacolare le difese del corpo contro il cancro. Tuttavia, il modello sferoide “è un approccio riduzionista”, avverte; il corpo umano, che ha un variegato arsenale di cellule immunitarie e un microbioma diversificato e ampiamente benefico, può avere altri meccanismi che impediscono ai tumori di metastatizzare.
Lo studio era piccolo e includeva solo due tipi di cancro, aggiunge Straussman, il che lascia molto lavoro da fare. Ma “la ricerca di Bullman ci ha mostrato come dovremmo esplorare il microbioma tumorale”, dice. “Questo documento ha portato sul campo un grande passo avanti”.