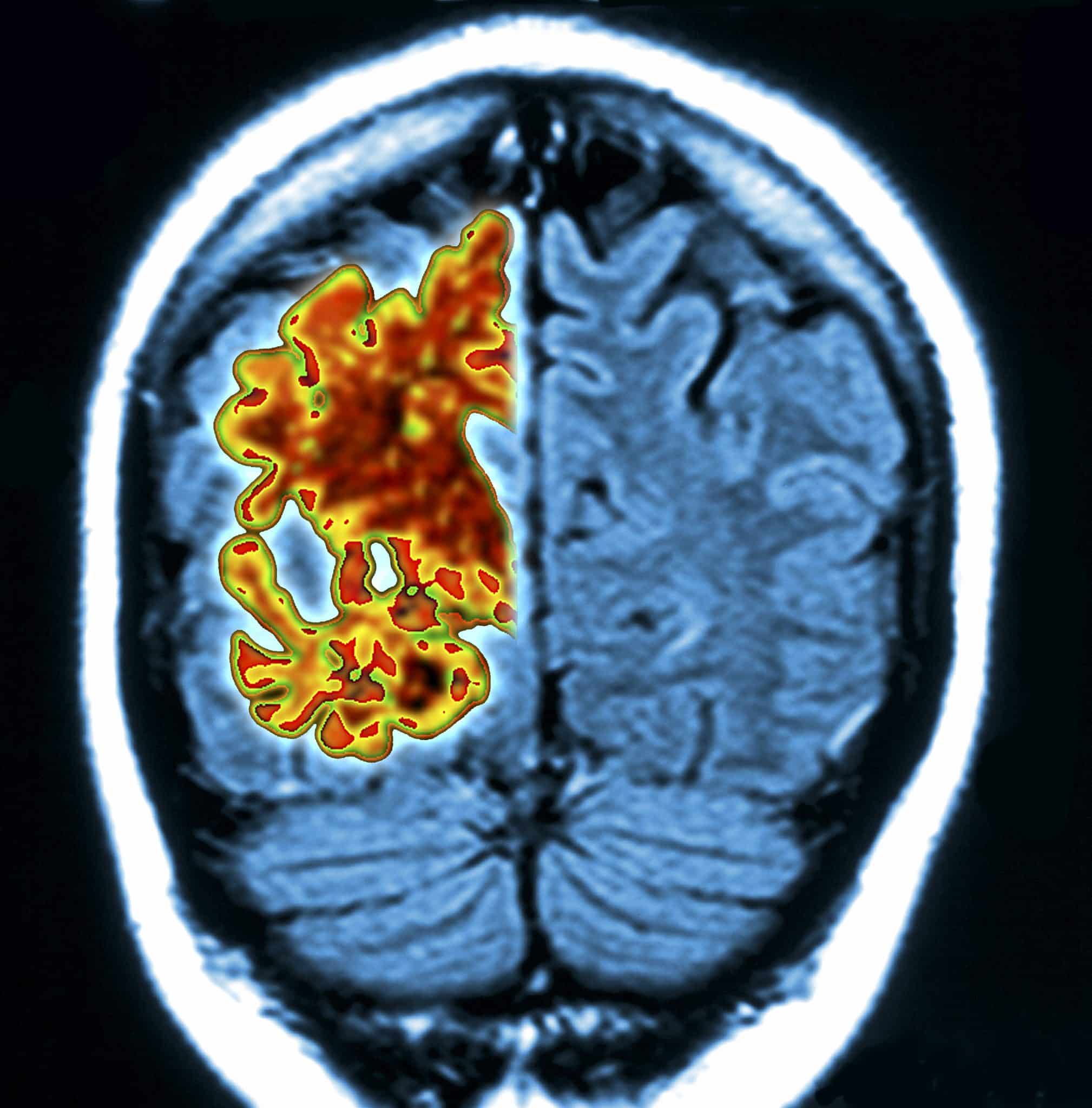
Un team di neurologi, specialisti di cellule staminali e biologi molecolari affiliati a diverse istituzioni negli Stati Uniti e guidati da un gruppo della School of Medicine dell’Università di Stanford, ha trovato prove che la causa principale del morbo di Alzheimer potrebbe essere l’accumulo di grasso nelle cellule cerebrali.

Lo studio è stato pubblicato sulla rivista Nature.
Nuove ricerche sulla malattia di Alzheimer
Precedenti ricerche hanno suggerito che la malattia di Alzheimer è causata da un accumulo di beta-amiloide nelle placche che crescono tra le cellule nervose . Altri lavori hanno coinvolto anche una proteina chiamata tau, che può accumularsi nelle cellule cerebrali .
Pertanto, la maggior parte del lavoro svolto nello sviluppo di metodi per prevenire, rallentare o arrestare la malattia si basa sulla riduzione o sull’eliminazione di tali accumuli. Ma come hanno scoperto i ricercatori con questo nuovo sforzo, potrebbe esserci qualcos’altro alla radice dello sviluppo della malattia.
Ai tempi in cui la malattia di Alzheimer fu identificata per la prima volta da Alois Alzheimer, notò che oltre alle placche e all’accumulo di tau, c’era anche un accumulo di goccioline di grasso nelle cellule cerebrali.
Da allora, sono stati fatti pochi sforzi per determinare se potessero essere la causa della malattia.
Il gruppo di ricerca si è quindi concentrato sulla funzione del gene APOE: ricerche precedenti avevano dimostrato che codifica per una proteina coinvolta nel trasporto delle goccioline di grasso nelle cellule nervose.
Ricerche precedenti hanno anche dimostrato che esistono quattro varianti di APOE, numerate da 1 a 4, e che una di queste, APOE4, trasporta la maggior parte di grasso nelle cellule cerebrali, mentre APOE2 ne porta meno.
Il team si è chiesto se le varianti APOE comportassero rischi diversi per lo sviluppo della malattia di Alzheimer. Per scoprirlo, hanno condotto alcuni esperimenti.
Nel primo esperimento, i ricercatori hanno utilizzato il sequenziamento dell’RNA di singole cellule per identificare le proteine all’interno di una cellula nervosa di prova.
Hanno applicato ciò che hanno trovato a campioni di tessuto raccolti da persone morte di Alzheimer che avevano doppie copie di APOE4 o APOE3.
Hanno scoperto che il cervello delle persone con il gene APOE4 aveva più cellule immunitarie con un tipo di enzima che aumentava il movimento delle goccioline di grasso nelle cellule cerebrali.
In un altro esperimento, hanno scoperto che l’applicazione dell’amiloide alle cellule cerebrali di persone con le varianti APOE4 o APOE3 faceva sì che le cellule accumulassero più grasso.
Secondo i ricercatori, i risultati indicano che l’accumulo di amiloide nel cervello innesca la spinta del grasso nelle cellule cerebrali, portando alla malattia.
Accumulo di proteine sulle goccioline di grasso implicato nella malattia di Alzheimer a esordio tardivo
Sarah Cohen, Ph.D., ricercatrice della UNC School of Medicine, e Ian Windham, ex Ph.D. uno studente del laboratorio Cohen, hanno fatto una nuova scoperta sull’apolipoproteina E (APOE), il più grande fattore di rischio genetico per la malattia di Alzheimer a esordio tardivo.
Le persone anziane che hanno ereditato una variante genetica chiamata APOE4 dai loro genitori hanno un rischio due o tre volte maggiore di sviluppare una malattia neurodegenerativa a esordio tardivo. Se i ricercatori riuscissero a comprendere meglio come l’APOE4 influisce sulle cellule cerebrali, ciò potrebbe aiutarli a progettare terapie efficaci e a colpire i meccanismi che causano l’aumento del rischio di malattia.
Cohen e Windham hanno condotto uno studio eccezionalmente approfondito, durato cinque anni, per comprendere meglio e visualizzare la relazione tra APOE4, il morbo di Alzheimer, e le molecole di grasso chiamate lipidi nel cervello.
“Abbiamo scoperto che le cellule cerebrali conosciute come astrociti sono più vulnerabili ai danni e possono persino diventare disfunzionali quando l’APOE4 circonda i loro centri di stoccaggio dei lipidi”, ha detto Cohen, assistente professore di biologia e fisiologia cellulare e autore senior dell’articolo pubblicato sul Journal of Cell. Biologia . “Questo meccanismo potrebbe spiegare perché proprio l’APOE4 aumenta il rischio di Alzheimer a livello cellulare”.
Il sessanta per cento della massa secca del cervello è composta da lipidi, che svolgono ruoli importanti nel cervello, come immagazzinare energia cellulare e formare la mielina, che circonda e isola i neuroni. I lipidi si trovano in compartimenti specializzati di stoccaggio del grasso noti come goccioline lipidiche all’interno degli astrociti.
Per quanto utili possano essere, i lipidi possono anche diventare tossici se le condizioni sono giuste. Quando sono eccitati o stressati, i neuroni rilasciano lipidi tossici nell’ambiente. Gli astrociti hanno il compito di ripulire i lipidi tossici fluttuanti e impedire loro di accumularsi nel cervello.
Se gli astrociti dovessero risultare danneggiati o disfunzionali in qualche modo, non potrebbero svolgere le loro funzioni di pulizia. Di conseguenza, anche altre cellule cerebrali, chiamate microglia, non riescono a ripulire le placche di beta-amiloide nel cervello, un altro fattore trainante della malattia di Alzheimer.
L’APOE è prodotto dagli astrociti. Proprio come un taxi o un Uber, la proteina sovrintende al rilascio e al trasporto dei lipidi tra i tipi di cellule nel cervello. Windham e Cohen volevano vedere cosa succede esattamente con i lipidi negli astrociti. Windham ha guidato l’iniziativa, creando un sistema di etichettatura e marcatura che avrebbe permesso loro di vedere le viscere degli astrociti in azione al microscopio.
“L’etichettatura dell’APOE con una proteina fluorescente verde ci ha permesso di vedere i diversi posti in cui va l’APOE all’interno delle cellule viventi”, ha detto Windham, ora ricercatore post-dottorato presso la Rockefeller University e primo autore dell’articolo.
Il team ha prima alimentato gli astrociti con acido oleico , un acido grasso omega-9 prodotto naturalmente nel corpo. Utilizzando un microscopio, il team ha osservato la consueta formazione di goccioline lipidiche. APOE4, sorprendentemente, si è avvicinato alle goccioline lipidiche come una calamita e ha cambiato la forma e la dimensione delle goccioline.
È diventato evidente ai ricercatori che l’APOE4 può sfuggire alla secrezione, chiudersi all’interno degli astrociti e migrare nelle goccioline lipidiche all’interno degli astrociti .
Windham e Cohen ipotizzano che la composizione alterata delle goccioline lipidiche potrebbe causare la disfunzione degli astrociti e influenzare la capacità della microglia di eliminare la beta amiloide.
Sono necessarie ulteriori ricerche per conoscere i dettagli. Cohen spera che i loro risultati sottolineino ulteriormente il ruolo delle goccioline lipidiche nel morbo di Alzheimer e in altre malattie neurodegenerative.
“Nel primo articolo di Alois Alzheimer, ha descritto tre caratteristiche della malattia neurodegenerativa: placche di beta-amiloide, grovigli di tau e accumuli di lipidi”, ha detto Cohen.
“I primi due hanno ricevuto molta attenzione. La prossima frontiera sono i lipidi. Poiché l’APOE è il più grande fattore di rischio genetico, riteniamo che contenga gli indizi su come i lipidi si inseriscono nella storia.”
Il ruolo dei lipidi nello sviluppo della malattia di Alzheimer
I neuroni nel cervello coesistono e fanno affidamento su molti altri tipi di cellule per funzionare correttamente. Gli astrociti, che prendono il nome dalla loro forma a stella, assicurano la sopravvivenza dei neuroni nutrendoli e disintossicandoli con l’aiuto di una proteina multifunzionale, l’APOE.
Una delle tre forme di questa proteina, APOE4, aumenta significativamente il rischio di sviluppare la malattia di Alzheimer, ma i meccanismi in gioco sono sconosciuti.
Una collaborazione tra l’Università di Ginevra (UNIGE), il Laboratorio europeo di biologia molecolare (EMBL), l’Università di Zurigo e l’azienda farmaceutica AbbVie ha scoperto un potenziale meccanismo: lungi dal smettere di funzionare, APOE4 è al contrario più efficiente.
Attivando la secrezione lipidica astrocitica, provoca l’accumulo di lipidi potenzialmente tossici che sono dannosi per i neuroni e quindi potrebbero contribuire allo sviluppo della malattia di Alzheimer.
Questi risultati, pubblicati sulla rivista Cell Reports , gettano nuova luce sui meccanismi neurodegenerativi di una malattia che colpisce quasi 50 milioni di persone in tutto il mondo.
Gli astrociti, presenti in gran numero nel cervello, hanno un’importante funzione protettiva. Queste cellule secernono l’apolipoproteina E (o APOE), una piccola proteina che forma particelle contenenti lipidi e vitamine per nutrire i neuroni.
Inoltre disintossica i neuroni liberandoli dai “rifiuti lipidici” che potrebbero diventare dannosi se non rimossi. Poiché i neuroni non sono in grado di eliminare da soli questi rifiuti, entra in gioco l’APOE per raccoglierli e riportarli negli astrociti dove vengono distrutti.
Il gene che codifica per l’APOE esiste in tre varianti frequenti nell’uomo: APOE2, presente nell’8% della popolazione, APOE3, il più comune, e APOE4, che si riscontra in quasi il 15% delle persone e aumenta il rischio di sviluppare la malattia di Alzheimer di un fattore dieci.
“Le ragioni per cui l’APOE4 aumenta il rischio di malattia di Alzheimer in modo così significativo non sono ben comprese”, spiega Anne-Claude Gavin, professoressa presso il Dipartimento di Fisiologia cellulare e metabolismo presso la Facoltà di Medicina dell’UNIGE e titolare di una cattedra della Fondazione Louis-Jeantet. , che ha diretto questa ricerca insieme a Viktor Lakics, ricercatore e leader dell’area biologica nella scoperta delle neuroscienze presso AbbVie.
Quali sono i meccanismi dietro la disfunzione di APOE4? E soprattutto, potrebbero servire come base per la prevenzione o la terapia? Per rispondere a queste domande, Anne-Claude Gavin e il suo team hanno unito le forze con scienziati del Laboratorio europeo di biologia molecolare (EMBL), dell’Università di Zurigo e di AbbVie.
Lavorando su queste domande, il gruppo di ricerca ha identificato nuovi meccanismi molecolari che spiegano come l’APOE si lega alle membrane degli astrociti per rilevare ed estrarre i lipidi di cui ha bisogno.
Utilizzando linee cellulari umane con diverse varianti di APOE, gli esperimenti in vitro hanno dimostrato che l’APOE è molto efficiente nel trasportare i lipidi potenzialmente dannosi prodotti nei neuroni.
“E con nostra grande sorpresa, la variante APOE4 si è rivelata ancora più efficiente delle altre forme”, rivela Katharina Beckenbauer, ex post-doc nel gruppo di Anne-Claude Gavin, scienziata senior presso AbbVie e una delle prime autrici dello studio il lavoro.
“Quindi, contrariamente a quanto pensavamo fino ad ora, il problema non è che l’APOE4 smetta di funzionare, ma proprio il contrario. E il meccanismo va in tilt.”
Man mano che gli astrociti invecchiano, diventano meno efficienti e iniziano ad accumulare lipidi invece di distruggerli.
“Abbiamo modellato questo processo sperimentalmente e osservato le molecole secrete dagli astrociti”, spiega Karina Lindner, Ph.D. studente nel laboratorio di Anne-Claude Gavin e uno dei primi autori di questo lavoro.
“Abbiamo osservato che l’invecchiamento cellulare devia l’APOE dalla sua funzione primaria – trasportare i lipidi ai neuroni e anche recuperare i lipidi da essi – verso la secrezione di trigliceridi, particolari specie lipidiche che potrebbero diventare dannose se non rimosse.”
E questo fenomeno è esacerbato dall’APOE4: stimola la secrezione dei trigliceridi, portando al loro accumulo incontrollato.
Questo deleterio accumulo di lipidi potenzialmente dannosi potrebbe benissimo contribuire in modo importante alla morte neuronale, un segno distintivo della malattia di Alzheimer. “APOE4 avrebbe quindi la capacità di accelerare il processo patologico della malattia attraverso il meccanismo che abbiamo scoperto.”
Per comprendere meglio i dettagli dell’azione dell’APOE e soprattutto della variante E4, gli scienziati dell’UNIGE vogliono ora determinare come viene regolata la secrezione di questi lipidi potenzialmente dannosi e se questa secrezione può essere rilevata nelle persone affette da malattia di Alzheimer.