Una squadra di scienziati dell’Università della California, Irvine e l‘Istituto Italiano di Tecnologia hanno realizzato una nuova molecola, ALY101, che ha dimostrato una promettente attività antitumorale contro un’ampia gamma di tipi di cellule tumorali e in modelli murini di un tipo comune di melanoma e malattie rare.
Lo studio “Progettazione basata sulla struttura degli inibitori dell’interazione con effettori CDC42 per il trattamento del cancro“, è stato pubblicato sulla rivista scientifica Cell Reports.
Molecola ALY101: ecco cosa hanno scoperto gli scienziati
Grazie alla collaborazione tra Marco De Vivo, direttore del Molecular Modeling and Drug Discovery Laboratory dell’IIT, e il laboratorio di Anand Ganesan, professore di dermatologia all’UCI, è stato possibile integrare gli studi di chimica computazionale e i sistemi di analisi biologica di entrambe le istituzioni, ottenendo così un risultato unico, utile allo sviluppo di farmaci che agiscono per bloccare le interazioni proteina-proteina che sono alla base dei processi cellulari di base, tra cui l’inizio del tumore, la crescita, la metastasi e la formazione dei vasi sanguigni. Queste interazioni fanno parte del meccanismo cellulare che può diventare disregolato in malattie come il cancro e la neurofibromatosi.
Lo studio ha interessato inizialmente il blocco dell’interazione dei membri della famiglia delle GTPasi CDC42 con una chinasi chiave, PAK1, che è amplificata nei tumori della mammella, del colon e di altri tumori e attiva nella patologia di malattie rare come la neurofibromatosi e il sarcoma di Ewing.
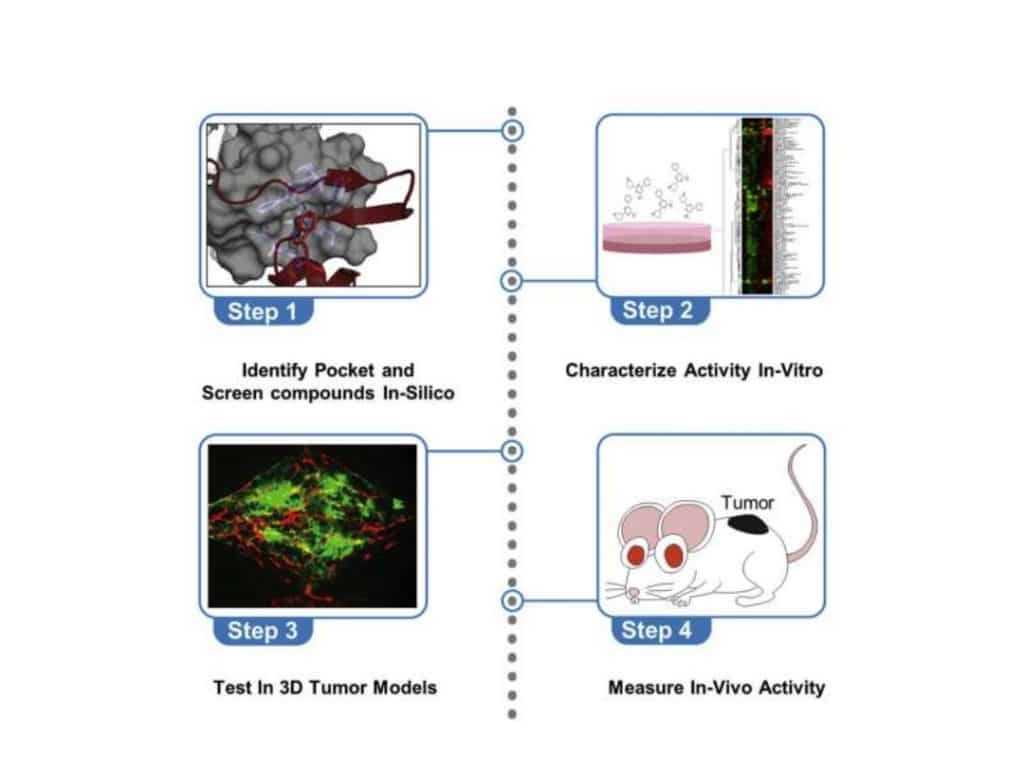
“Abbiamo identificato una tasca di legame PAK1 precedentemente sconosciuta presente solo in CDC42 e abbiamo utilizzato questa tasca all’interfaccia tra entrambe le proteine per interrompere l’interazione che normalmente porterebbe all’attivazione di PAK1. Bloccando questa interazione, possiamo inibire l’eccessiva attività di PAK1 che guida i cambiamenti cellulari che portano al cancro e ad altre malattie“, ha affermato De Vivo.
“Abbiamo utilizzato simulazioni al computer di entrambe le proteine per progettare composti in grado di legarsi a quella tasca e modellato il blocco dell’interazione tra entrambe le proteine utilizzando una gamma di composti simulati che abbiamo ‘selezionato‘ per in silico e quindi sintetizzati quelli più promettenti per ulteriori sperimentazioni prove“, ha continuato l’esperto
In particolare, il composto principale scoperto nella collaborazione, ALY101, funziona bloccando l’interazione, che normalmente converte PAK1 da uno stato inattivo a uno attivo. Altri ricercatori hanno dimostrato che la soppressione o l’inibizione dell’attività PAK1 nelle cellule tumorali sensibilizza a un’ampia gamma di diversi agenti antitumorali, migliorando la loro attività antitumorale.
Questo approccio razionale per la progettazione di farmaci basati sulla struttura è stato completamente integrato con i flussi di lavoro del test di biologia umida nel laboratorio Ganesan dell’UCI.
“Questo composto e gli effetti del farmaco sul tumore e sul suo microambiente hanno potenziali applicazioni sia in monoterapia che in regimi combinati per ridurre le tossicità dose-limitanti degli agenti esistenti, o come trattamento per tumori che hanno sviluppato resistenza ad altri agenti”, ha affermato Ganesan . “In un contesto più ampio, questi studi forniscono una tabella di marcia per la progettazione razionale basata sulla struttura di farmaci che prendono di mira le proteine dei membri della famiglia GTPase, note per essere un’importante, ma difficile da mirare per il trattamento del cancro”.
Questi risultati hanno anche portato al lancio di una start-up, Alyra Therapeutics, dedicata all’espansione della piattaforma sviluppata da De Vivo e Ganesan e all’ulteriore sviluppo di ALY101 e altri composti come nuovi potenziali trattamenti per cancro, neurofibromatosi e altre malattie in cui piccole GTPasi e le loro interazioni di segnalazione giocano un ruolo nella patologia della malattia.
Il programma principale di Alyra, ALY101, è stato sviluppato da questo lavoro e agisce per ripristinare i normali processi di segnalazione cellulare che possono diventare disregolati nei pazienti con alcuni tipi di cancro e malattie rare come la neurofibromatosi di tipo 2.
“Siamo estremamente lieti di vedere la pubblicazione del lavoro del Dr. De Vivo e Ganesan che delinea l’attività di ALY101“, ha affermato Mark Benedyk, Presidente e CEO di Alyra. “L’approccio integrato perseguito da entrambi i laboratori ha generato in modo efficiente più composti che bloccano l’interazione CDC42/PAK1, convalidando la nostra piattaforma e sono in corso progetti simili per affrontare altre piccole proteine GTPasi al di fuori della famiglia CDC42. Il significato della loro scoperta per quanto riguarda il il potenziale trattamento del cancro e della neurofibromatosi di tipo 2 non può essere sottovalutato”.
La neurofibromatosi di tipo 2 è una malattia caratterizzata dalla crescita di tumori non cancerosi nel sistema nervoso. I tumori più comuni associati alla neurofibromatosi di tipo 2 sono chiamati schwannomi vestibolari o neuromi acustici. Queste escrescenze si sviluppano lungo il nervo che trasporta le informazioni dall’orecchio interno al cervello (il nervo uditivo). Anche i tumori che si verificano su altri nervi si trovano comunemente con questa condizione.
I segni ei sintomi della neurofibromatosi di tipo 2 di solito compaiono durante l’adolescenza o all’inizio dei vent’anni, sebbene possano iniziare a qualsiasi età. I primi sintomi più frequenti degli schwannomi vestibolari sono la perdita dell’udito, ronzio nelle orecchie (acufene) e problemi di equilibrio.
Nella maggior parte dei casi, questi tumori si verificano in entrambe le orecchie all’età di 30 anni. Se i tumori si sviluppano in altre parti del sistema nervoso, i segni ei sintomi variano a seconda della loro posizione. Le complicanze della crescita del tumore possono includere alterazioni della vista, intorpidimento o debolezza delle braccia o delle gambe e accumulo di liquidi nel cervello. Alcune persone con neurofibromatosi di tipo 2 sviluppano anche opacità del cristallino in uno o entrambi gli occhi, spesso a partire dall’infanzia.